03.02.2006
Basisinfo
Alternativen zu Antibiotikaresistenz-Genen
Markergene: Es geht auch anders
Markergene - das sind bisher meistens Antibiotikaresistenz-Gene. Doch es gibt Alternativen.
Markergene sind notwendig, um nach einer Transformation aus einer großen Zahl von Pflanzenzellen jene zu finden, welche die gewünschten neuen Gene aufgenommen haben. Als Alternative zu Antibiotikaresistenz-Genen kommen verschiedene physiologische Marker in Frage - Gene, welche den natürlichen Stoffwechsel der Pflanzen beeinflussen.
Mit Hilfe solcher physiologischer Marker kann eine Pflanze Stoffe abbauen, die normalerweise für sie giftig sind. Anders als bei den Resistenzgenen ist jedoch ihre Verwendung als Markergen auf bestimmte Pflanzen beschränkt. Man muss den Stoffwechsel der jeweiligen Pflanze genau kennen und ausschließen können, dass das Markergen in diesen eingreift und neue oder veränderte Stoffwechselprodukte in der Pflanze entstehen. Die dazu notwendigen Kenntnisse sind derzeit für viele Pflanzen noch nicht vorhanden.
In Projekten des 2004 abgeschlossenen SiFo-Programms wurden einige dieser neuen physiologischen Marker weiterentwickelt und anschließend auf ihre Praxistauglichkeit untersucht.
2-DOG-System
- Das System beruht darauf, dass die Zuckerart 2-Deoxyglucose (2-DOG) für Pflanzen normalerweise toxisch ist, da sie die Atmung und das Zellwachstum hemmt. Von 2-DOG-resistenten Hefezellen weiß man, dass ihre Resistenz auf einer Überexpression des Gens für ein bestimmtes Enzym (2-Deoxyglucose-6-Phosphat- Phosphatase) beruht.
- Dieses Gen wurde in Kartoffelpflanzen eingebaut: Das 2-DOG-System war unter Feldbedingungen wirksam. Es konnten keine Unterschiede zwischen den transgenen Pflanzen und den Kontrollpflanzen festgestellt werden. Damit scheint ein praktischer Einsatz des Gens als Marker zur Selektion transgener Pflanzen grundsätzlich möglich.
- Ob das 2-DOG-System tatsächlich ohne Sicherheitsbedenken anwendbar ist, soll weiter untersucht werden.
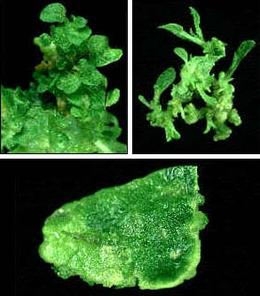
Tabak: Zellwachstum und Kohlenhydratquellen.
Auf den Fotos sind nicht-transgene Tabak-Blattstückchen auf Nährmedien mit verschiedenen Zuckern als Kohlenhydratquelle zu sehen. Es ist zu erkennen, dass sich aus den Blattstückchen sowohl mit Glucose (oben links) als auch mit Mannose (oben rechts) Sprosse bilden. Nur Palatinose (unten) kann von Tabakzellen nicht verwertet werden.
Palatinose-System
- Pflanzenzellen können mit Saccharose-Isomeren – chemischen Verwandten unseres Haushaltszuckers - wie z.B. Palatinose nichts anfangen: Palatinose wird von Pflanzenzellen weder aufgenommen noch verwertet.
- Transformierte Pflanzenzellen, die ein Enzym (= Palatinase) besitzen, das Palatinose in Fructose (Fruchtzucker) und Glucose (Traubenzucker) spaltet, können dagegen auf Palatinose als einziger Kohlenhydratquelle leben. Normale Pflanzen gehen ein, wenn sie nur Palatinose erhalten.
- Im Rahmen des Forschungsprojekts gelang es, das Palatinase-Gen in Tabakpflanzen einzuführen. Es wurde zwar „abgelesen“ (exprimiert), jedoch kein funktionsfähiges Protein gebildet. Auch mit verschiedenen Variationen des Gens bzw. des Konstrukts konnte keine Palatinase-Enzymaktivität in den transgenen Tabakpflanzen erreicht werden.
Diese physiologischen Markergen-Systeme sind jedoch nicht die einzigen, an denen gearbeitet wird.
Mannose-System
Wird ein in vielen Pflanzen natürlicherweise nicht vorhandenes Enzym-Gen (Mannose-6-Phosphat-Isomerase) eingeschleust, kann die Pflanze auf Mannose-haltigen Nährböden wachsen. Mannose ist wie Palatinose eine spezielle Zucker-Variante, die von vielen Pflanzen nicht verstoffwechselt werden kann. Allerdings gibt es viele Pflanzenarten wie Tabak, die Mannose als Kohlenhydratquelle verwerten können. Bei diesen ist der Mannose-Marker nicht einsetzbar.
Farbstoff-Marker
Außerdem gibt es visuelle Marker, die Farbstoffreaktionen auslösen (Bildung von Anthocyanen oder Carotinoiden). Der damit verbundene Eingriff in den Stoffwechsel ist aber nicht immer mit den Zielen der gentechnischen Veränderung vereinbar. Auch ein grün fluoreszierendes Gen (gfp) kann als Markergen eingesetzt werden. Da der Farbstoff nur unter dem Mikroskop sichtbar wird, ist der Arbeitsaufwand sehr groß, da alle Zellen einzeln angeschaut werden müssen. Für Nutzpflanzen mit geringer Transformationseffizienz ist dieses Gen als Marker nicht zu verwenden.
Thematische Verknüpfungen
EU-Zulassungen
In der EU ist die Zulassung von Pflanzen beantragt bzw. genehmigt, bei denen das Mannose-System als Marker verwendet wurde.
