08.03.2010
Basisinfo
Transformation mit Agrobakterien
Ein Bodenbakterium als Gen-Fähre
Seit über zwanzig Jahren werden Agrobakterien eingesetzt, um neue Gene in Pflanzenzellen einzuschleusen. Seitdem wurde das Verfahren mehrfach optimiert.
Die Agrobakterien-vermittelte Transformation ist eine der am häufigsten verwendeten Methoden, um neue Gene in Pflanzenzellen zu transportieren und stabil in deren Genom einzubauen. Sie wird inzwischen bei vielen Kulturarten angewandt.
Agrobakterien: "Natürliche" Gentechnik
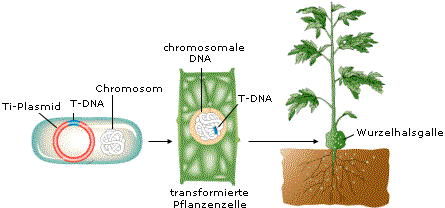
Das für diese Methode genutzte Agrobacterium tumefaciens ist ein Bodenbakterium, das in kultivierten und nicht kultivierten Böden vorkommt und an verwundeten Pflanzenstellen Wucherungen (Wurzelhalsgallen) hervorrufen kann. Ursache dafür ist die natürliche Fähigkeit der Agrobakterien, die genetische Information für die Wurzelgallen- (Tumor-) Bildung in das Pflanzengenom einzufügen. Diese T-DNA (=transferred DNA) liegt nicht auf dem Chromosom der Agrobakterien, sondern auf einem Plasmid (Ti-Plasmid = tumor-induzierendes Plasmid), eingerahmt von zwei Grenzbereichen, der rechten und der linken Border (RB und LB).
Agrobakterien schaffen es, Pflanzen mit „natürlichen“ Mitteln gentechnisch zu verändern - und erstaunlicherweise gelingt ihnen das auch, wenn die ursprüngliche T-DNA mit der Information für die Tumorbildung aus dem Ti-Plasmid entfernt und statt dessen ein fremder DNA-Abschnitt zwischen die beiden Grenzbereiche integriert wird (im folgenden ebenfalls T-DNA genannt). So kann das Agrobakterium als „Transportvehikel“ für neu einzuführende Gene genutzt werden. Da man einen Indikator benötigt, um transformierte Zellen erkennen zu können, wird auch ein Markergen mit integriert.
Erfolgreich transformierte Pflanzenzellen können zu neuen Pflänzchen regeneriert werden.
Binäre Vektoren: Aus eins wird zwei
Da es aufwändig ist, Fremd-DNA in ein Ti-Plasmid einzubringen, und da große Plasmide nicht sehr effizient transformiert werden, benutzt man heute meistens so genannte binäre Vektoren.
Dabei wird die DNA, die in die Pflanzenzelle eingeschleust werden soll, nicht in das Ti-Plasmid integriert, sondern wird - eingerahmt von RB- und LB-Sequenzen - in ein zweites Plasmid eingebracht. Aus dem Ti-Plasmid wird die T-DNA-Region mitsamt rechter und linker Border entfernt, es behält aber die so genannten Virulenzgene (vir-Gene), deren Aktivität für die Übertragung der T-DNA in das Pflanzengenom erforderlich ist. Ein solches Ti-Plasmid wird auch als Helfer-Ti-Plasmid bezeichnet. Beide Plasmide werden in einem Agrobakterien-Stamm zusammengeführt, mit dem anschließend eine Pflanze infiziert wird.
Binäre Plasmide sind deutlich kleiner als ein normale Ti-Plasmide. Deshalb sind sie stabiler, technisch einfacher zu handhaben und können mit höherer Effizienz transformiert werden.
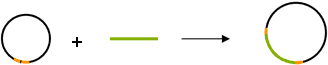
Erster Schritt: Der zu übertragende DNA-Abschnitt (grün) mit Zielgen und Markergen wird in ein Plasmid integriert, eingerahmt von RB- und LB-Sequenzen (gelb). Dieser Vektor wird in E.coli-Bakterien vermehrt.

Zweiter Schritt: Das Plasmid mit der zu übertragenden DNA wird in einen Agrobakterien-Stamm überführt, der ein Helfer-Ti-Plasmid ohne T-DNA enthält.
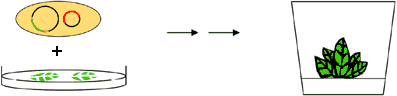
Dritter Schritt: Gemeinsame Kultivierung von Agrobakterien und Pflanzen-Blattstückchen. Das eine Plasmid überträgt die „fremde“ T-DNA, das andere hilft durch die Aktivität seiner vir-Gene bei der Transformation. Die nicht transformierten Zellen werden mit Hilfe des Markergens selektiert. Aus den Blattstückchen werden wieder Pflanzen regeneriert.
Cotransformation: Übertragung zweier unabhängiger T-DNAs
Mehrere SiFo-Projekte haben sich mit der Optimierung binärer Vektoren beschäftigt. Ein wichtiges Ziel war die Entwicklung von Vektoren, die für die gleichzeitige Übertragung von zwei T-DNAs geeignet sind. Dadurch sollte es ermöglicht werden, Zielgen und Markergen unabhängig voneinander in das Pflanzengenom zu integrieren, sie später durch Segregation wieder voneinander zu trennen und so transgene, markergen-freie Pflanzen zu erhalten.
Für eine Cotransformation mit Hilfe von Agrobakterien sind verschiedene Anordnungen von Markergen (rot) und Zielgen (grün) möglich.
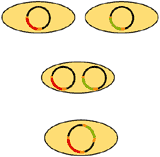
Schaubild: Verschiedene Möglichkeiten der Übertragung zweier unabhängiger T-DNAs durch Cotransformation. Die Helfer-Ti-Plasmide sind nicht mit abgebildet.
- Zwei verschiedene Agrobakterien-Stämme mit je einem Vektor zur Transformation; ein Vektor enthält das Markergen, der andere das Zielgen (Abbildung oben). Diese Anordnung ist bei Gerste besonders erfolgreich.
- Ein Bakterienstamm mit zwei Vektoren mit je einem Gen (Mitte). Diese Anordnung ist bei Raps und Tabak am erfolgversprechendsten.
- Ein Bakterienstamm mit einem Vektor, auf dem beide Gene an getrennten Stellen angeordnet sind (unten). Diese Anordnung ist z.B. bei Arabidopsis (Ackerschmalwand) besonders erfolgreich.
Bei der Weiterentwicklung der binären Vektoren wurden verschiedene Eigenschaften optimiert:
- Entfernung nicht benötigter Sequenzen. Um mit einem Plasmid zwei T-DNAs übertragen zu können, musste der Vektor weiter verkleinert werden. Es konnten DNA-Sequenzen entfernt werden, die nicht unbedingt auf dem Plasmid lokalisiert sein müssen. So konnte die Größe des Vektors etwa halbiert werden (kleiner als 5 kb).
- "Undichte" linke Border. Der Transfer und die Integration der T-DNA ins Pflanzengenom beginnen bei der RB (rechte Border) und enden bei der LB (linke Border). Lange Zeit galt die linke Border als „undicht“. Es kam häufig vor, dass auch Sequenzen außerhalb der T-DNA mit übertragen wurden, manchmal sogar das gesamte Plasmid. Je nach Ausmaß und Art der über die „undichte“ LB hinaus übertragenen Sequenzen ist die Freisetzung oder Züchtung solcher transgener Pflanzen problematisch, da nicht alle übertragenen Gene bzw. DNA-Sequenzen erwünscht sind. Es wurden Vektoren entwickelt, mit denen eine präzisere Integration der T-DNA ermöglicht werden soll. Dazu wurde die als linke Begrenzung der T-DNA (left border) verwendete die Terminationssequenz („Stopp-Signal“) doppelt oder gar vierfach eingesetzt.
Thematische Verknüpfungen
Themen
Jenny fragt: Wie funktioniert die Genübertragung mit Agrobakterien?
Zu Gast bei AgroSience in Neustadt a. d. Weinstraße
Streitfall Markergene