26.03.2009
Forschung Projekte
Erzeugung Markergen-freier Reben durch Nutzung des Cre/lox-Rekombinationssystems
(2005 – 2008) RLP AgroScience GmbH, Neustadt / Weinstraße
Thema
Markergene können unter anderem mit Hilfe von Rekombinationssystemen wieder aus den transgenen Pflanzen entfernt werden. Am Beispiel des Tabaks wurde in einem vorangegangenen Forschungsprojekt erfolgreich das transiente Cre/loxP-System angewendet. Dabei schneidet das Enzym Cre-Rekombinase das zwischen zwei loxP-Erkennungssequenzen lokalisierte Markergen aus dem Pflanzengenom heraus. Transient bedeutet, dass dieses Enzym nur in einem bestimmten Zeitraum in der Pflanze aktiv ist (transiente Expression).
Das Cre/loxP-System soll in diesem Teilprojekt auf Reben übertragen und optimiert werden. In einem zweiten Teilprojekt wird das System bei Rapspflanzen angewendet. Ein weiteres Ziel des Projektes ist es, das Rekombinationssystem mit wirtschaftlich relevanten Genen zu verknüpfen, z.B. solchen, die eine vermitteln.
Vorläuferprojekt:
Informationen zum Verfahren:
Zusammenfassung
Ziel dieses Projektes war es, Markergene mit einem vorübergehend wirkenden Rekombinationssystem (Cre/loxP) aus Reben zu entfernen. Der Vorteil dieses Systems besteht darin, dass es keinen anschließenden Kreuzungsschritt benötigt, um markergen-freie Pflanzen zu erhalten. Es ist daher besonders für die Rebe geeignet, da sie ausschließlich vegetativ vermehrt wird.
- Grundsätzlich konnte die Funktionalität des Systems in Blättern der Rebe nachgewiesen werden.
- Die Übertragung der Rekombinase durch Infektion mit einem Virusklon, welcher das cre-Gen trägt, konnte weder mit der Modellpflanze Tabak noch mit der Rebe erzielt werden.
- Ein alternatives System, das einen induzierbaren Promotor zur vorübergehenden Expression der des cre-Gens verwendet, wird zur Zeit an das System der embryogenen Rebenzellkultur angepasst.
Versuchsbeschreibung

Weinreben im Reagenzglas. Das Ziel dieses Projekts ist die Entwicklung einer Methode zur Entfernung von Antibiotikaresistenz-Markern (z. B. das nptII-Gen) aus transformierten Pflanzen.

Selektion: Wenn die jungen Pflanzen auf Antibiotika-haltigem Medium wachsen, war die Transformation erfolgreich. Sie enthalten das Markergen, das ihnen die Antibiotika-Resistenz verleiht.
Foto: Dr. G.M. Reustle, RLP-AgroScience GmbH
Herstellung lox-transgener Reben. Aus Antheren, den Staubgefäßen der Blüten, wurden embryogene Reben-Zellkulturen gewonnen. Diese Zellen wurden mittels Agrobakterien transformiert. Auf dem so übertragenen Genkonstrukt liegt das für die Selektion benötigte Markergen zwischen zwei loxP Erkennungssequenzen. Außerhalb davon liegt ein ebenfalls übertragenes Reportergen für ein fluoreszierendes Protein, dessen Expression jedoch durch das Markergen verhindert wird. Nach der Cre-vermittelten Rekombination signalisiert die nun auftretende Fluoreszenz, dass das Markergen erfolgreich aus dem Pflanzengenom herausgeschnitten wurde. Später soll anstelle des Gens für das fluoreszierende Protein ein Gen zur möglichen Erzeugung einer Pilzresistenz eingeführt werden.
Modifizierung des infektiösen Virusklons. Für die Rebe gibt es derzeit nur wenige infektiöse Viren, die als Klone zur Verfügung stehen. Der Virenklon wird benötigt, um die Cre-Rekombinase transient (vorübergehend) in der Rebe zu bilden und das Markergen aus dem Pflanzengenom zu entfernen. Dafür sollte in diesem Projekt ein infektiöser Klon eines Nepovirus hergestellt werden, welcher das Cre-Rekombinase-Gen besitzt.
Eliminierung des Markergens . Junge, transgene Pflanzen wurden mit dem Virus infiziert. Durch molekularbiologische Nachweismethoden, PCR- und Southern-Blot-Techniken, wurde überprüft, ob das Markergen erfolgreich aus dem Pflanzengenom herausgeschnitten wurde. Stabile, markergenfreie Pflanzen sollten anschließend zur Eliminierung der Viren einer Thermotherapie unterzogen und die virusfreien Reben herausgesucht werden.
Ergebnisse

Embryogene Reben-Zellkultur. Sie kann mittels Agrobakterien transformiert werden.
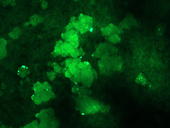
Die Fluoreszenz zeigt die erfolgreiche Rekombination in der Pflanzenzelle an.

Expression von Anthocyan in einem keimenden Reben-Embryo, nachdem das Selektionsmarkergen und das cre-Gen entfernt wurden. Ein spezieller induzierbarer Promotor aktiviert das cre-Gen. Die Rekombinase entfernt das cre-Gen und das Selektionsmarkergen. Dann kann das Gen für den roten Farbstoff Anthocyan abgelesen werden.
Fotos: Dr. G.M. Reustle, RLP-AgroScience GmbH
Herstellung der Gen-Konstrukte. Im ersten Projektjahr erfolgte der Aufbau der für die Transformation von Reben geeigneten loxP-Konstrukte. Hierzu wurde zur Selektion ein Antibiotika-Resistenzmarker (nptII; Kananamycin-Resistenz) zwischen die beiden loxP-Sequenzen insertiert. Mit Hilfe von Agrobakterien wurde das loxP-Konstrukt in embryogenes Gewebe der Reben übertragen.
Um nach der Transformation mit den loxP-Sequenzen auch eine visuelle Selektion durchführen zu können, wurde ein weiteres Konstrukt hergestellt. Dazu wurde ein Fluoreszenzmarkergen (YFP; gelb fluoreszierendes Protein) mit dem Selektionsmarkergen (nptII) gekoppelt. Mit der Transformation dieses modifizierten loxP-Konstruktes in embryogenes Rebenzellen wurde im Frühjahr 2006 begonnen. Zusätzlich wurden in 2005 Tabakzellen erfolgreich mit den loxP-Konstrukten transformiert und aus diesen Pflanzen regeneriert. Damit ist eine funktionelle Kontrolle des Cre/loxP-Systems möglich.
Modifizierung des infektösen Virusklons. Der infektiöse Virusklon wurde im ersten Projektjahr (2005) modifiziert. Die anschließende Impfung der Pflanzen (2006) mit dem modifizierten Virusklon führte trotz einer Vielzahl von Experimenten mit Variationen der verschiedenen Parameter zu keiner Infektion der Pflanzen - weder bei den Modellpflanzen noch der Rebe.
Zur Verbesserung der Infektiosität erfolgte in 2005 außerdem die Überführung des modifizierten Klons in ein Vektor-System, das zur Transformation mit Agrobakterien verwendet werden kann. Mit der Anwendung dieses Systems im folgenden Projektjahr, konnte jedoch auch keine Infektion der Pflanzen erzielt werden.
Eliminierung des Markergens. Im Jahr 2006 wurde das Cre-Rekombinase-Gen mittels Agrobakterien in loxP-transgene Tabakpflanzen übertragen. Mit Hilfe von PCR konnten in den Blättern Rekombinationsereignisse nachgewiesen werden. Nach der funktionalen Kontrolle des Cre/loxP-Systems an der Modellpflanze konnte anschließend auch in Blättern loxP-transgener Reben die Eliminierung des Markergens gezeigt werden.
Alternative Strategie. Im Jahr 2008 wurde ein Genkonstrukt hergestellt, bei dem das Selektionsmarkergen zusammen mit dem Cre-Rekombinase-Gen zwischen den lox-Sequenzen liegt. Dabei wird die Aktivität des Rekombinase-Gens durch einen speziellen induzierbaren Promotor aus Mais reguliert. Nach der Induktion werden sowohl das Selektionsmarkergen, als auch das cre-Gen entfernt.
Zur Erfolgskontrolle wurde das Gen für einen roten Farbstoff (Anthocyan) in das Konstrukt integriert. Dieses Gen kann erst abgelesen werden, nachdem das Selektionsmarkergen und das cre-Gen entfernt worden sind. Dann färben sich die Zellen rot.
Das Konstrukt konnte inzwischen in die Modellpflanze Tabak und in embryogene Zellen verschiedener Linien von Unterlagsreben übertragen werden. In allen Fällen entstanden nach der Induktion des Promotors bei den Keimlingen rot gefärbte Bereiche. Aktuell werden die Induktionsbedingungen für den Promotor in verschiedenen Geweben und Entwicklungsstadien getestet.
Thematische Verknüpfungen
Themen
Förderung
Bundesministerium für Bildung und Forschung
Förderkennzeichen
0313264P
Projekt
Originaltitel
Markergen-Eliminierung mit dem Cre/lox-Rekombinationssystem durch transiente Expression des Rekombinasegens Teil B: Markergen-Eliminierung aus mehrjährigen Holzpflanzen am Beispiel der Weinrebe mit Hilfe eines neu entwickelten infektiösen Klons von RpRSV
Kontakt
Dr. habil. Goetz M. Reustle
RLP AgroScience GmbH, AlPlanta Institut für Pflanzenforschung
Breitenweg 71
67435 Neustadt
Tel. 06321 / 671 1302
Veröffentlichungen
Wein-Forschung

Goetz Reustle vom AlPlanta Institut für Pflanzen- forschung in Neustadt a.d. Weinstraße über Gentechnik in der Rebenzüchtung und das „emotionale Produkt“ Wein.
Forschung live:
Forschungsprojekte
Optimierung der biologischen Sicherheit transgener Pflanzen 2005-2008
- Markergenelimierung mit dem Ac/Ds-System; Universität Braunschweig
- Erzeugung Markergen-freier Getreidepflanzen durch androgenetische Segregation; IPK Gaterleben
- Erzeugung Markergen-freier Reben durch Nutzung des Cre/lox-Systems; AgroScience, Neustadt
- Erzeugung Markergen-freier Rapspflanzen durch Nutzung des Cre/lox-Systems; Universität Rostock
- Gezielter Einbau von Genen mittels Gene Targeting; Universität Karlsruhe
- Gezielter Einbau von Genen bei gleichzeitiger Entfernung des Markergens durch ortsspezifische Rekombinationssysteme; Universität Hamburg
- Männlich sterile Pflanzen verhindern die Verbreitung von Transgenen; Universität Würzburg
