29.10.2012
Forschung Projekte
Herstellung eines Bt-Proteinstandards und Optimierung der Nachweismethoden
(2008 – 2011) Dienstleistungszentrum Ländlicher Raum (DLR) Rheinpfalz, Abteilung Phytomedizin, Neustadt an der Weinstraße
Thema
Für den Verbund der Sicherheitsforschungsprojekte zu gentechnisch verändertem Bt-Mais (MON89034 x MON88017), der drei verschiedene Bt-Proteine bildet, wurden
- standardisierte Bt-Proteine hergestellt und
- eine einheitliche Messmethode entwickelt und etabliert, mit der die jeweilige Menge der in Maispflanzen gebildeten Bt-Proteine erfasst werden kann.
Bt-Proteinstandards und eine einheitliche Methode zum quantitativen Nachweis der Toxine sind notwendig, damit die Ergebnisse der verschiedenen Teilprojekte vergleichbar sind.
Der produzierte Bt-Proteinstandard wurde den Projekten des Verbundes zur Verfügung gestellt.
Zusammenfassung
Die drei Bt-Proteine Cry1A.105, Cry2Ab2 und Cry3Bb1 wurden im Labor im E. coli-Stamm BL21-DE3 hergestellt und anschließend gereinigt. In Fütterungsversuchen mit Maiszünsler- und Kartoffelkäferlarven wurde die Bioaktivität der Proteine überprüft. Dabei wurden die Protein-Konzentrationen bestimmt, bei denen die Hälfte der Larven starb. Die Proteine wurden den Projektpartnern für weitere Versuche zur Verfügung gestellt.
Fütterungsversuche ergaben keine eindeutigen Hinweise darauf, dass sich die beiden Proteine Cry1A.105 und Cry2Ab2 in ihrer Wirkung gegenseitig verstärken oder abschwächen. Eine verstärkte Wirkung bei Vorhandensein aller drei Bt-Proteine konnte nicht nachgewiesen werden.
Die Konzentration der Bt-Proteine war in den Blättern der Maispflanzen am höchsten, in den Maispollen und -körnern am niedrigsten. Bis zur Blüte nahm der Gehalt an Bt-Proteinen in den Pflanzenteilen zu.
Versuchsbeschreibung
Herstellung der Bt-Proteine
Um größere Mengen der Bt-Proteine herstellen zu können, wurden die Gene, die die Information dafür tragen, isoliert und in Kolibakterien (Escherichia coli) eingeschleust. Kultiviert man die Bakterien unter geeigneten Bedingungen, produzieren sie die Bt-Proteine.
Der Bt-Mais wurde für vier bis sechs Wochen im Gewächshaus herangezogen. Dann wurden die jungen Blätter der Pflanze geerntet und daraus die DNA isoliert. Aus der Gesamt-DNA der Maispflanzen wurden die Gene für die Bt-Proteine mit Hilfe der Polymerase-Kettenreaktion (PCR) selektiv vervielfältigt. Anschließend wurde jedes Gen in ein Plasmid eingebracht, das in Bakterien eingeschleust wurde.
Die Bakterien wurden kultiviert und die von ihnen produzierten Bt-Proteine isoliert und gereinigt. Anschließend wurden ihre Konzentration und ihr Reinheitsgrad bestimmt. Für jedes Bt-Protein mussten die Bedingungen für die Kultivierung, Isolierung, Reinigung und Lagerung gesondert optimiert werden. Außerdem mussten die in E.coli produzierten Proteine immunologisch charakterisiert werden, um sicherzustellen, dass sie mit den Proteinen aus den gentechnisch veränderten Pflanzen vergleichbar sind.
Aus dem letzten Projekt stand bereits ein Bakterienstamm zur Verfügung, der eins der drei Bt-Proteine produziert.

Mit Hilfe eines ELISA-Tests können die Bt-Proteine in pflanzlichem Gewebe gemessen werden.
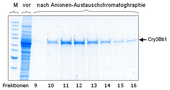
Cry3Bb1-Protein vor und nach der Reinigung. Die Proteine werden in einem elektrischen Feld nach ihrer Größe aufgetrennt (Elektrophorese). Zum Vergleich ist in der Spur ganz links ein Gemisch von Proteinen bekannter Größe aufgetragen. So kann man überprüfen, ob das aus den Maispflanzen isolierte Protein die richtige Größe hat.
Kontrolle der Bioaktivität der hergestellten Bt-Proteine
Die Bioaktivität, d.h. Toxizität der in E.coli hergestellten Bt-Proteine, muss an den Zielorganismen getestet werden. Da der Maiswurzelbohrer in Deutschland noch ein Quarantäne-Schädling ist, wurde er durch den mit ihm verwandten Kartoffelkäfer ersetzt. Dafür musste zunächst eine Kartoffelkäferzucht etabliert werden. Eine Maiszünslerzucht gab es am DLR Rheinpfalz bereits.
Unterschiedliche Konzentrationen der Bt-Proteine wurden auf die Nahrungsquelle frisch geschlüpfter Maiszünsler- bzw. Kartoffelkäferlarven aufgebracht. Nach sieben Tagen wurde die Anzahl der gestorbenen Larven bei jeder Konzentrationsstufe berechnet und die Sterblichkeitsrate bestimmt.
Um zu überprüfen, ob sich die Bt-Proteine in ihrer Wirkung
gegenseitig verstärken oder abschwächen, wurden diese Versuche auch mit Kombinationen von zwei sowie allen drei Bt-Proteinen zusammen durchgeführt. Diese Tests dienten auch als Grundlage für Untersuchungen von Nicht-Zielorganismen in anderen Teilprojekten.
Bestimmung der Bt-Proteinkonzentration in verschiedenen Pflanzenteilen
Die Konzentration der Bt-Proteine in pflanzlichem Gewebe kann mit Hilfe der Nachweismethode ELISA gemessen werden. Für zwei der drei Bt-Proteine, die von der untersuchten Maissorte produziert werden, mussten die Messmethoden entwickelt und optimiert werden.
Zu drei verschiedenen Wachstumszeitpunkten wurden die Bt-Proteingehalte in verschiedenen Pflanzenteilen (Wurzel, Stängel, unteres und oberes Blatt, Pollen, Fruchtfäden und Kolben) ermittelt. Als Bezugsgröße wurden Frisch- und Trockengewichte der Proben bestimmt. Es wurde untersucht, wie hoch die Schwankungen zwischen einzelnen Pflanzen sind und ob sich die Bt-Proteingehalte im Laufe der Pflanzenentwicklung verändern.
Ergebnisse
Herstellung der Bt-Proteine
Es wurden jeweils zehn Pflanzen der Bt-Maislinie MON89034 x MON88017 sowie der isogenen Linie im Gewächshaus angezogen. Aus den jungen Blättern der Pflanzen wurde die DNA der drei Cry-Gene isoliert, vervielfältigt und die Sequenz bestimmt.

Elektrophorese der in einem E. coli-Stamm (BL21-DE3) gebildeten Proteine Cry1A.105 (A) und Cry2Ab2 (B)
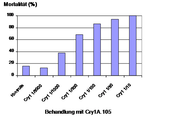
Versuche zur Bioaktivität:
Sterblichkeit von Maiszünsler-Larven (L1), die auf Medien mit verschiedenen Konzentrationen Cry1A.105 gewachsen sind. Die Sterblichkeit wurde nach sieben Tagen bestimmt.
Für die Expression der drei Bt-Proteine wurden Plasmide mit den Bt-Genen hergestellt und in E. coli-Bakterien eingebracht. Die Expressionsbedingungen und die Reinigung der Proteine wurden optimiert. Die Proteine Cry2Ab2 und Cry3Bb1 wurden sowohl in der Form von Proteineinschlusskörpern (inclusion bodies), als auch als gelöstes Protein gebildet, wohingegen Cry1A.105 ausschließlich in unlöslicher Form als inclusion body produziert wurde. Durch die Reinigung der Proteine wurde ein Reinheitsgrad von 72 bis 82 Prozent erreicht.
Kontrolle der Bioaktivität der hergestellten Bt-Proteine
Anhand der Sterblichkeit der Maiszünsler- und Kartoffelkäferlarven wurde die mittlere Letalkonzentration (LC50) berechnet. Der LC50-Wert lag in einem Bereich zwischen 0,001 und vier Mikrogramm pro Quadratzentimeter, wobei der höchste LC50-Wert für das Protein Cry3Bb1 ermittelt wurde.
Die Versuche, in denen die Bt-Proteine Cry1A.105 und Cry2Ab2 kombiniert an Maiszünslerlarven verfüttert wurden, ergaben nicht eindeutig, dass sich die beiden Proteine in ihrer Wirkung gegenseitig verstärken oder aufheben. In weiteren Versuchen mit allen drei Bt-Proteinen zeigte sich, dass die Proteine sich gegenseitig in ihrer Wirkung nicht verstärken.
Bestimmung der Bt-Proteinkonzentration in verschiedenen Pflanzenteilen
Mit Hilfe der Nachweismethode ELISA wurden die drei Bt-Proteine in verschiedenen Pflanzenteilen quantitativ bestimmt. Die Konzentration der drei Proteine war in den Maispollen und Maiskörnern am niedrigsten. Die höchsten Konzentrationen wurden in den Maisblättern nachgewiesen. Das Protein Cry3Bb1 wurde in den Maispflanzen stärker gebildet als die beiden anderen Bt-Proteine. Der Gehalt an Cry1A.105 war am geringsten. Die Cry-Proteinkonzentrationen waren in allen Pflanzenteilen relativ starken Schwankungen unterworfen.
Mehr bei bioSicherheit
Thematische Verknüpfungen
Förderung
Bundesministerium für Bildung und Forschung
Förderkennzeichen
0315215G
Projekt
Originaltitel
Herstellung und Nachweis multipler Cry-Proteine in transgenem Mais
Kontakt
Dr. Johannes Jehle
Julius Kühn-Institut
Institut für Biologischen Pflanzenschutz
Heinrichstraße 243
64287 Darmstadt
Forschungsprojekte
Verbundprojekt: Freisetzungsbegleitende Sicherheitsforschung an Mais mit multiplen Bt-Genen 2008-2011
- Bindung von Bt-Toxinen an Bodenpartikel, IBT Göttingen
- Auswirkungen auf Nematoden, IBN Regensburg
- Herstellung eines Bt-Toxinstandards und Optimierung der Nachweismethoden, DLR Neustadt
- Auswirkungen auf Maisstroh abbauende Mikroorganismen, ZALF Müncheberg
- Auswirkungen auf Arthropoden, RWTH Aachen
- Auswirkungen auf Regenwürmer, RWTH Aachen
- Auswirkungen auf Schmetterlinge, RWTH Aachen
- Auswirkungen auf Bodenmikroorganismen, vTI Braunschweig
- Auswirkungen auf Honigbienen, Universität Würzburg
- Auswirkungen auf Laufkäfer und Spinnen, LfL Freising
