01.06.2012
Forschung Projekte
Entwicklung einer Technik zur zielgerichteten Integration von Genen bei Pflanzen
(2008 – 2011) Universität Karlsruhe, Botanisches Institut, Lehrstuhl für Molekularbiologie und Biochemie der Pflanzen
Thema
Bei der Übertragung neuer Gene in Pflanzen ist nicht vorhersehbar, an welcher Stelle sie in das Genom eingebaut werden. Dadurch können andere Gene in ihrer Funktion beeinflusst werden. Ein gezielter Einbau an bekannten und gut definierten Stellen im Genom könnte diese Unsicherheit ausschließen.
Ziel dieses Projektes war es, eine Technik weiterzuentwickeln, mit der ein Transgen spezifisch an jeder gewünschten Stelle in ein Pflanzengenom integriert werden kann (Gene targeting). Grundlage für diese Technik ist die homologe Rekombination, ein natürlich vorkommender Mechanismus zur Neukombination des Erbguts. Die bisher entwickelten Gene Targeting-Techniken für Pflanzen funktionieren noch nicht effizient, d.h. das Transgen wird zu selten zielgerichtet in das Pflanzengenom eingebaut.
In der Modellpflanze Arabidopsis thaliana konnten drei Gene (BRCA1, BRCA2 und BARD1) identifiziert werden, deren Ausfall dazu führt, dass deutlich weniger homologe Rekombinationsereignisse stattfinden. In dem hier beschriebenen Ansatz sollte nun versucht werden, durch eine überhöhte Expression dieser Gene einen Anstieg homologer Rekombinationsereignisse zu erreichen, um damit in Zukunft die Effizienz von Gene targeting-Systemen für Pflanzen zu erhöhen Vorläuferprojekt:
Informationen zum Verfahren:
Zusammenfassung
In Arabidopsis konnte gezeigt werden, dass eine Überexpression von BRCA1 und BARD1 alleine oder zusammen nicht zu einer erhöhten Rate der homologen Rekombination führt. Es ist dadurch auch kein positiver Effekt auf das Gene Targeting zu erwarten.
Außerdem wurden Linien erzeugt, die BRCA2 überexprimieren, sie konnten jedoch noch nicht abschließend getestet werden. Wegen massiver Probleme mit der BRCA2-Transformation sowie der Stabilität der Expression ist es aber so gut wie ausgeschlossen, dass dies ein gangbarer Weg zur Erhöhung der Targeting-Effizienz sein könnte.
Es konnte also aufgrund der nicht vorhersehbaren Probleme (z.B. Gene Silencing) kein effizientes Gene Targeting in Pflanzen etabliert werden.
Versuchsbeschreibung
In einem ersten Schritt wurden Arabidopsis-Pflanzen mit den drei genannten Genen transformiert, und zwar sowohl einzeln als auch in verschiedenen Kombinationen. Die Überexpression der Gene wurde durch die Wahl geeigneter Steuerelemente (Promotoren) herbeigeführt. Mit molekularbiologischen Methoden wurden die Orte im Pflanzengenom untersucht, an der die Gene eingebaut wurden. Mit Hilfe einer Farbreaktion wurde getestet, welche Gene bzw. Genkombinationen zu einem Anstieg homologer Rekombinationsereignisse führen.
Ergebnisse
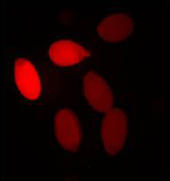
Rot fluoreszierende Samen. Das in die Pflanzen eingebrachte Reportergen exprimiert in den Samen ein Protein, das rot leuchtet, wenn es mit geeignetem Licht angeregt wird.
Es wurden Genkonstrukte mit unterschiedlichen Promotoren (Ubiquitin-Promotor oder doppelter 35S-Promoter) hergestellt, die eine Überexpression der Gene BRCA1 und BARD1 hervorrufen sollten. Zusätzlich enthielten die Konstrukte Antibiotikaresistenz-Gene. Mit diesen Konstrukten wurden Arabidopsis-Pflanzen transformiert. Durch anschließende Selektion auf einem Antibiotika-haltigen Nährmedium (PPT) konnten mehrere transgene Linien identifiziert werden. Diese wurden durch Selbsten vermehrt, um die Nachkommen erneut einzeln auf dem Nährmedium selektieren zu können. Ziel war es, Nachkommen zu erhalten, die die transgene DNA nur an einem einzigen Ort im Genom enthalten. So sollten unerwünschte Effekte wie eine Inaktivierung des Transgens verhindert werden.
Die Nachkommen der transformierten Pflanzen mit 35S-Promotor konnten auf dem PPT-haltigen Nährmedium nicht wachsen. Weitere Untersuchungen zeigten, dass es aufgrund einer zu hohen Zahl von 35S-Promotoren im Pflanzengen zu einer Inaktivierung des Resistenzgens gekommen war. Daher konnten keine Pflanzen hergestellt werden, bei denen die transgene DNA nur an einem einzigen Ort im Genom enthalten ist (sog. single-locus-Pflanzen).
Für die Pflanzen mit Ubiquitin-Promotor konnten solche single-locus-Linien hergestellt werden und die BRCA1 bzw. BARD1 einzeln bzw. auch in Kombination überexprimieren. Diese Linien wurden auf einen Anstieg der homologen Rekombinationsereignisse hin untersucht.
Sowohl für die BRAC1-Linien als auch für die Linien, die beide Gene enthielten, konnte keine Zunahme der homologen Rekombination beobachtet werden. Nur für einige BARD1-Linien war eine leichte Erhöhung der Rekombination zu verzeichnen.
Aufgrund dieser für biotechnologische Anwendungen schlechten Ergebnisse wurden beide Ansätze dahingehend überprüft, ob die Transgene überhaupt stärker exprimiert wurden als normal.
Im Vergleich zu dem Wildtyp zeigte sich sowohl für die meisten BRAC1-Linien als auch bei den BRAD1-Linien nur eine sehr geringe Überexpression der Transgene. Nur bei einigen Linien, die beide Gene enthielten, war eine stark erhöhte Expression zu finden. Dabei war die BARD1-Überexpression immer stärker als die BRACA1-Überexpression. Trotz dieser erfolgreichen Überexpression der beiden Gene war es aber auch hier nicht möglich, die Rate der homologen Rekombination auf ein vielversprechendes Niveau zu heben.
Außerdem wurde ein Genkonstrukt hergestellt, das in Arabidopsis eine Überexpression des BRCA2-Gens auslöst. Trotz experimenteller Schwierigkeiten konnten mit diesem Genkonstrukt 70 transgene Arabidopsis-Linien hergestellt werden. Aus diesen Pflanzen wurden dann nach mehreren Anläufen nur vier homozyote single-Locus-Pflanzen gewonnen. Bei drei Linien konnte zwar eine Überexpression des BRACA2-Gen nachgewiesen werden, jedoch zeigten alle Linien Defekte wie z.B. Sterilität.
Thematische Verknüpfungen
Förderung
Bundesministerium für Bildung und Forschung
Förderkennzeichen
0315210E
Projekt
Originaltitel
Etablierung einer Gene Targeting Technik bei Pflanzen
Kontakt
Prof. Dr. Holger Puchta
Universität Karlsruhe
Botanisches Institut
Lehrstuhl für Molekularbiologie und Biochemie der Pflanzen
76128 Karlsruhe
Forschungsprojekte
Verbundprojekt: Optimierung der biologischen Sicherheit gentechnisch veränderter Pflanzen 2008-2011
- Wie zuverlässig ist der Anbau von männlich sterilem Mais zur Begrenzung der Ausbreitung? JKI Quedlinburg
- Verhinderung der Ausbreitung von gentechnisch verändertem Mais durch transgen-freien Pollen, Universität Hamburg
- Plastidentransformation zur Verhinderung der Ausbreitung gentechnisch veränderter Pflanzen, MPI Potsdam
- Entwicklung einer Plastidentransformations- technologie für Mais, MPI Potsdam
- Transgene Zitterpappeln: Überprüfung der Zuverlässigkeit männlicher Sterilitätssysteme, vTI Großhansdorf
- Verhinderung der Ausbreitung von gentechnisch veränderten Pappeln durch transgen-freien Pollen, vTI Großhansdorf
- Gezielter Einbau von Genen an definierten Positionen im Rapsgenom, TU Braunschweig
- Entwicklung einer Technik zur zielgerichteten Integration von Genen bei Pflanzen, Universität Karlsruhe
