Energie nach dem Vorbild der Natur
Ruthenium als Katalysator für die künstliche Wasserspaltung

Ruthenium ist ein seltenes Edelmetall, das zu den Platinmetallen gerechnet wird. Die Forscher untersuchten ein Rutheniumoxid, das die Wasserspaltung effizient katalysieren kann. (Quelle: © Heinrich Pniok (www.pse-mendelejew.de), Lizenz CC BY-NC-ND 3.0)
Italienische Wissenschaftler untersuchen einen künstlichen Metallkomplex, an dem nach dem Vorbild der Photosynthese effizient Wasser gespalten werden kann.
Die Photosynthese ist die wichtigste chemische Reaktion auf unserem Planeten. Ohne sie gäbe es keine Sauerstoff-Atmosphäre, das Leben, so wie wir es kennen, wäre nicht möglich. Dabei wandeln Pflanzen die Sonnenenergie durch Wasserspaltung in chemische Energie um und speichern sie in langkettigen Kohlenhydraten. Diese umweltfreundliche Form der Energiegewinnung beschäftigt Wissenschaftler und Ingenieure schon seit langem, besonders die Suche nach Möglichkeiten, die Wasserspaltung (Photolyse) künstlich nachzubauen. Wasser und Sonnenlicht sind auf der Erde nahezu unbegrenzt vorhanden, eine Energiegewinnung auf der Basis der Wasserspaltung würde langfristig einen Großteil der Energieprobleme lösen. Allerdings braucht man dazu geeignete Stoffe, die die nötigen chemischen Eigenschaften aufweisen und auch noch bezahlbar sind. Jetzt haben Forscher einen Metallkomplex untersucht, der sich zur künstlichen Wasserspaltung eignet.
Vorbild Photosynthese
Die Photosynthese läuft an den Membranen im Inneren der Chloroplasten ab. Die sogenannte Lichtreaktion besteht im Wesentlichen aus zwei Photosystemen. Die Wasserspaltung oder Photolyse ist dabei eng an das Photosystem II gekoppelt.
Um die für die Wasserspaltung nötige Spannung aufzubauen, gibt es den sogenannten „sauerstoffproduzierenden Komplex“ (oxygene-evolving complex, OEC) oder „Kok-Zyklus“. Er besteht im wesentlichen aus einem Mangan-Calcium-Cluster, einem Metallkomplex. Dieser gibt einzelne Elektronen an die durch ein Lichtquant „angeregten“ (oxidierten) Chlorophyllmoleküle ab. Dadurch baut sich im Cluster die nötige Spannung auf, um letztlich zwei Wassermolekülen vier Elektronen zu entziehen, wodurch das Wasser in vier Protonen und ein Sauerstoffmolekül zerfällt:
2H2O + 4 Lichtquanten --> O2 + 4H+ + 4e-
Eine künstliche Alternative: Ruthenium
Dieser Vorgang, der einer der wichtigsten in der Natur ist, wird intensiv erforscht. Gesucht werden geeignete Verbindungen, die in der Lage sind, ein genügend hohes Spannungspotential aufzubauen, so dass sie Wassermoleküle „aufbrechen“ können. Da organische Komponenten durch den hohen oxidativen Stress häufig „repariert“ werden müssten, suchen Wissenschaftler nach anorganischen Alternativen. Von besonderem Interesse sind dabei Moleküle mit Metalloxidzentren, an denen die Reaktion ablaufen kann. Problematisch erwies sich bisher, dass auch die Metalle durch den Kontakt mit Sauerstoff lediglich eine kurze Lebensdauer hatten. Ein interessantes Metall war für die Forscher daher Ruthenium, das sich in verschiedenen Experimenten als relativ stabil erwies.
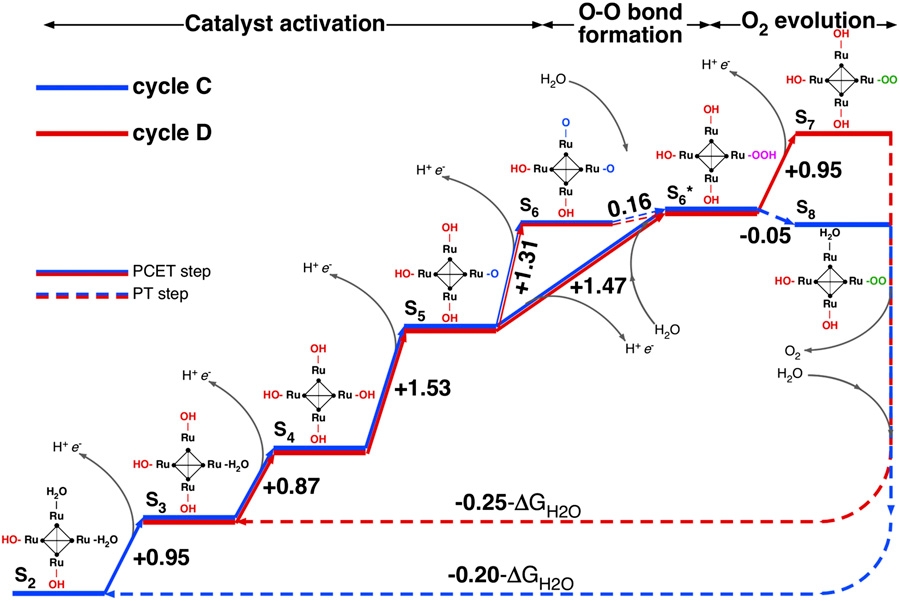
Ablauf der Reaktionen am Ru4-POM-Molekül (Quelle: © Piccinin et al. 2013)
Ruthenium (Ru) ist ein seltenes Edelmetall, das zu den Platinmetallen gerechnet wird. Es kommt in reiner Form vor, meistens aber in Platinerzen zusammen mit anderen Platinmetallen (Iridium, Osmium). Ein häufig vorkommendes Oxid ist Ruthenium-(IV)-Oxid (RuO2). Die Autoren der Studie haben nun ein weiteres Rutheniumoxid, Ru4-Polyoxometallat (Ru4-POM), untersucht. Ru4-POM ist bekannt dafür, dass es die Wasserspaltung effizient katalysieren kann und eine lange Lebensdauer hat. Die Wissenschaftler fanden nun durch Simulationen den grundlegenden Ablauf der Wasserspaltung heraus. Er läuft ähnlich ab wie am natürlichen Mn-Cluster in den Chloroplasten der Pflanzen: Das Molekül wird durch Elektronenabgabe in eine höhere Oxidationsstufe befördert, bis durch die spontane Anlagerung eines weiteren Wassermoleküls eine Hydroperoxo-Gruppe (-OOH*) entsteht, die in O2 und H+ zerfällt:
OOH* + 3H+ +3e- --> O2 +4H+ + 4e-
Die Forscher konnten nachweisen, dass innerhalb des Moleküls die vier Ruthenium-Atome als katalytische Zentren fungieren und mit ihrer Umgebung (dem Wasser) interagieren. Sie hoffen nun, dass die neugewonnen Einsichten in diese grundlegenden Prozesse helfen werden, eine neue Generation von Katalysatoren zur Wasserspaltung zu entwickeln und das teure Ruthenium möglichst durch preiswertere Metalle mit ähnlichen Eigenschaften zu ersetzen.
Quelle:
Piccinin, S. et al. (2013): Water oxidation surface mechanisms replicated by a totally inorganic tetraruthenium-oxo molecular complex. In: Proceedings of the National Academy of Sciences (PNAS), 11. März 2013, doi:10.1073/pnas.1213486110.
Weiterführende Informationen:
Zum Weiterlesen auf Pflanzenforschung.de:
- Nanokapseln für die künstliche Photosynthese
- Mit künstlicher Photosynthese Energie gewinnen
- Künstliche Blätter: Energiequellen der Zukunft
Titelbild: Ruthenium ist ein seltenes Edelmetall, das zu den Platinmetallen gerechnet wird. Die Forscher untersuchten ein Rutheniumoxid (Ru4-POM), das die Wasserspaltung effizient katalysieren kann. (Quelle: © Heinrich Pniok (www.pse-mendelejew.de), Lizenz CC BY-NC-ND 3.0)
