Phänotypen auf Knopfdruck
Forscher entwickeln Methode zur Steuerung der Phänotyp-Ausprägung von Vielzellern
Mithilfe ihrer Methode gelang es den Forschern, u. a. die Trichomentwicklung bei Arabidopsispflanzen zu steuern. (Bildquelle: © Heiti Paves/ wikimedia.org/ CC BY-SA 3.0)
Die Möglichkeit, die Phänotyp-Ausprägung mittels Kontrolle über Proteinlevel und -aktivitäten zu steuern, ist von großem Wert für Grundlagenforscher, aber auch industrielle Anwender. Speziell für eukaryotische Vielzeller fehlte es bislang jedoch an Methoden. Nun haben Forscher aus Deutschland eine raffinierte Lösung entwickelt und gleich an mehreren Modellorganismen getestet.
Der Umgang mit Genen und Genprodukten, die unerlässlich für lebenswichtige Funktionen sind, stellt Genforscher vor ein grundlegendes Problem: Wie können ihre Funktionen untersucht werden, wenn der Ausfall des Gens möglicherweise den Tod des Organismus nach sich zieht? Schließlich besteht das Vorgehen in der Regel darin, die Bedeutung eines Gens zu ermitteln, indem es zunächst ausgeschaltet wird. Anfang der 1990er gelang es, eine clevere Lösung zu finden, die auf der Nutzung konditionaler Mutanten basiert.
Ein neuer Baustein für die Biologie
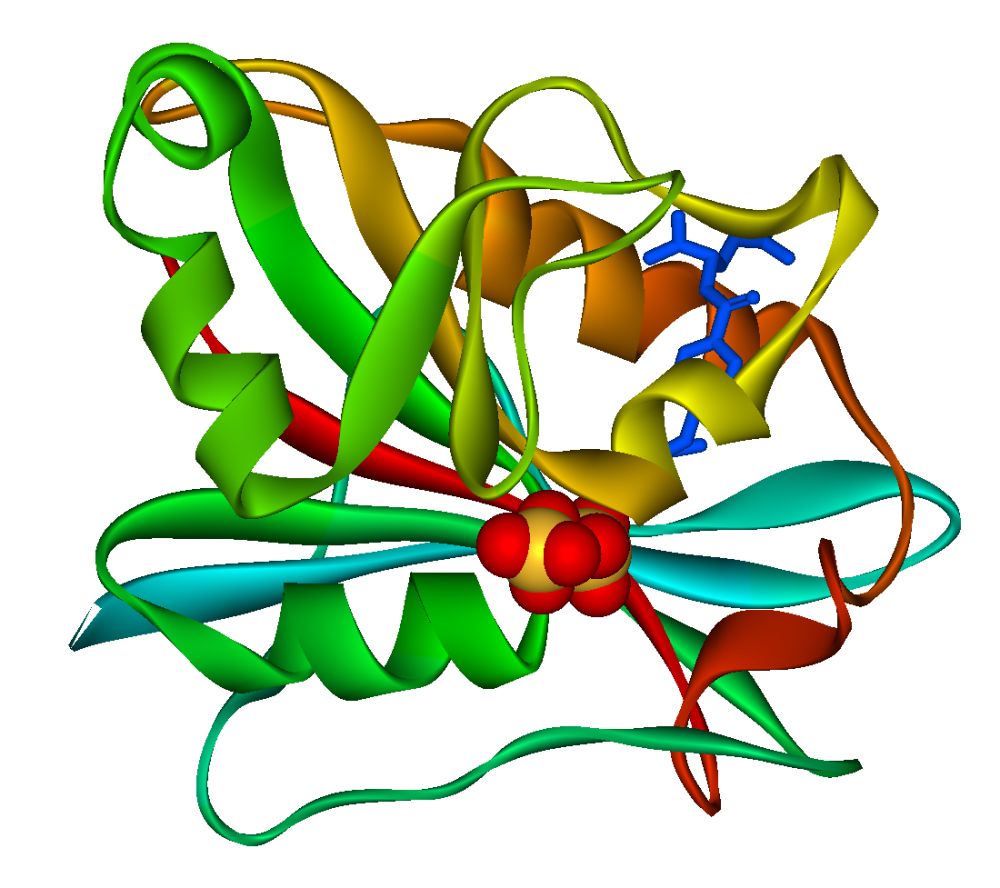
Um konditionale Mutanten entstehen zu lassen, die ab einer gewissen Temperatur einen gewissen Phänotyp zeigen, nutzt man das temperatursensible Enzym Dihydrofolatreduktase. Erreicht die Umgebungstemperatur einen gewissen Schwellenwert, beginnt das Enzym damit, das Protein, an dem es andockt, abzubauen.
Bildquelle: © Fvasconcellos/wikimedia.org; gemeinfrei
Von kaum geringerer Raffinesse ist auch das, was Forschern aus Deutschland auf Basis desselben Prinzips nun gelungen ist. Nicht nur, dass die Methode auf Vielzeller (Metabionta), wie Tiere, Pilze und Pflanzen, anwendbar sei, erklärt Teamleiter Nico Dissmeyer vom Leibniz-Institut für Pflanzenbiochemie (IPB) in Halle: „Mit unserer Forschung liefern wir der Synthetischen Biologie einen komplett neuartigen Baustein, mit denen Proteinfunktionen und Enzymaktivitäten „on demand“ moduliert werden können.“ Doch was genau steckt dahinter?
Was sind konditionale Mutanten?
Zunächst einmal gilt, Mutant ist nicht gleich Mutant. Man unterscheidet in diesem Zusammenhang zwischen konditionalen Mutanten und nichtkonditionalen Mutanten. Der Unterschied ist, dass bei Letzteren der durch eine Genmutation hervorgerufene Phänotyp unter allen Bedingungen ausprägt ist. Zum Beispiel, wenn durch das Ausschalten eines Gens ein Enzym nicht mehr gebildet wird. Bei konditionalen Mutanten hingegen tritt der einer Genmutation zugehörige Phänotyp nur unter bestimmten Bedingungen bzw. Konditionen auf, z. B. ab einer bestimmten Temperatur. Man spricht in diesem Zusammenhang deshalb auch von temperatursensitiven Mutanten. Sie wurden wie bereits erwähnt Anfang der 1990er entwickelt und spielen auch in der aktuellen Studie eine Rolle.
Eine Frage der richtigen Temperatur
Vor 25 Jahren machten es konditionale Mutanten erstmals möglich, sich mit der Erforschung lebenswichtiger Gene intensiv zu befassen. Denn anders als die nichtkonditionalen sind die temperatursensitiven nur – oder besser gesagt immerhin – bei niedrigen (sog. permissiven) Temperaturen lebensfähig. Dies ändert sich, sobald die Temperatur eine bestimmte Schwelle übersteigt und in den sogenannten restriktiven Bereich übergeht. Dem Forscher obliegt es vereinfacht gesagt, den Temperaturregler zu bedienen und zu beobachten, was passiert, um Rückschlüsse auf die Funktion des Gens zu ziehen. Doch was läuft dabei im Inneren der Mutanten ab? Die Antwort auf diese Frage erklärt auch, was sich hinter der Idee von Dissmeyer und seinen Kollegen verbirgt.
Proteinabbau bei Hitze
Konditionale Mutanten entstehen, indem an einem freien Ende der Polypeptidkette des zu untersuchenden Zielproteins ein Proteinkomplex, auch Proteinkassette genannt, angehängt wird, der zuvor in den Organismus eingeschleust wurde. Seine Aufgabe ist es, das Zielprotein abzubauen, sobald die Umgebungstemperatur besagte Schwelle überschreitet. Damit dies tatsächlich nur im vorgesehenen Temperaturbereich geschieht, ist der Komplex mit einem temperatursensiblen Enzym ausgestattet. Hierbei handelt es sich um die aus Mäusezellen gewonnene Dihydrofolatreduktase (DHFR).
Schwachstellen bisheriger Verfahren
In der Praxis heißt dies, dass der Phänotyp erst bei einer Umgebungstemperatur von 37 bis 42 Grad sichtbar wird. Und genau hierin liege eine Schwäche der ursprünglichen Methode, so die Forscher. Schließlich entspräche dies nicht dem realen Lebensumfeld vieler Organismen. Ferner komme hinzu, dass die Methode nur bei einzelligen Eukaryoten funktioniere, nicht aber bei Vielzellern. Ansätze, die speziell für diese Organismen in den letzten 10 Jahren entwickelt wurden, z. B. „TIPI“ (“TEV-protease induced protein inactivation”), „DD“ (“Destabilizing domain system“) oder „AID“ („Auxin inducible degron“), beschränkten sich jedoch nur auf Zellkulturen (in vitro) und kämen zudem nicht ohne den zusätzlichen Einsatz chemischer Verbindungen als Schlüsselreize oder Trigger aus.
Pflanzenhaare (Trichome) haben viele verschiedene Funktionen, sie können z. B. die Blätter vor Fraßfeinden oder Austrocknung schützen, Pflanzen beim Klettern behilflich sein oder wie abgebildet Flüssigkeiten produzieren, die dieser fleischfressenden Pflanze helfen, Insekten einzufangen.
Bildquelle: © Noah Elhardt/wikimedia.org; CC BY-SA 3.0
lt-Degrons als Kernelemente
Dissmeyer und seinem Team gelang es, eine Antwort auf die skizzierten Probleme zu finden und eine vielseitig anwendbare in vivo-Methode zu entwickeln. Kernstück ist ein von ihnen konstruierter Proteinkomplex namens „lt-Degron“. Zum Hintergrund: Degrons sind Proteinabschnitte, die speziell für den Proteinabbau (Proteolyse) zuständig sind. Sie sorgen u. a. für das geregelte Zusammenspiel vieler Proteine bei biochemischen Prozessen und für die Beseitigung fehlerhafter oder beschädigter Proteine. Das Kürzel lt steht für „low temperature“ und bezieht sich auf die Inaktivität des Komplexes bei niedrigen Temperaturen.
Vom Prinzip her ist vieles beim Alten geblieben: Es beginnt mit der Programmierung geeigneter lt-Degrons, damit diese mit den ausgewählten Zielproteinen fusionieren, und endet damit, dass der Forscher mit Hilfe des Temperaturreglers entscheidet, wann das Zielprotein abgebaut wird und sich der zugehörige Phänotyp zeigt. Praktisch ist, dass die eingeschleusten lt-Degrons durch eine Herabsenkung der Temperatur jederzeit wieder zurück in den inaktiven Zustand versetzt werden können, der ganze Prozess also reversibel ist.
Tests an einer Handvoll Modellorganismen
Den Beweis, dass ihre Methode funktioniert, lieferten die Wissenschaftler gleich anhand mehrerer Modellorganismen. Von Interesse sind hier die Tabakpflanze Nicotiana benthamiana und die Ackerschmalwand Arabidopsis thaliana. So gelang es bei Letzterer zum Beispiel, sowohl die Trichomentwicklung als auch die Blühinduktion zu kontrollieren.
Bei den Trichomen handelt es sich um haarähnliche Strukturen auf der Pflanzenoberfläche. Sie üben verschiedene Aufgaben und Funktionen aus, sei es als Schutz-, Drüsen- oder Stützhaar oder als absorbierendes Haar im Wurzelbereich. Da Trichome hinsichtlich ihrer Entstehung, ihres Aufbaus und Nutzens mittlerweile bestens erforscht sind, boten sie sich als Versuchsobjekt an.
Trichomentwicklung auf Wunsch
Hierfür zogen die Forscher Arabidopsis-Mutanten heran, in denen sie ihre lt-Degrons mit den Hauptregulatoren der Trichomentwicklung, den TRANSPARENT TESTA GLABRA1-Proteinen (TGG1), hatten verschmelzen lassen. Die erste Zeit ihres Lebens verbrachten die Zöglinge anschließend in den Temperaturkammern im Labor. Nach vier Wochen zeigten sich signifikante Unterschiede: Wuchsen die Pflänzchen in einer Umgebungstemperatur von 16 Grad auf, war ihre Oberfläche gespickt von feinen Trichomen. Ganz anders sah es bei ihren Geschwistern aus, die bei 29 Grad gehalten wurden. Dort waren die Trichome, wenn überhaupt, nur im Ansatz erkennbar, Blätter und Stängel größtenteils haarfrei.
Zwei Wochen früher in die nächste Wachstumsphase
Auch in Bezug auf die Blühinduktion zeigte sich, dass es nun prinzipiell möglich ist, mittels Temperatur zu bestimmen, wann eine Pflanze aus dem vegetativen Wachstum in das reproduktive Wachstum übergeht. In diesem Fall war das Zielprotein der Transkriptionsfaktor CONSTANS (CO). Die Forscher beobachteten, dass entsprechende Mutanten zwei Wochen früher mit der Blütenbildung begannen, wenn sie statt bei mollig warmen 29 Grad bei kühlen 13 Grad aufwuchsen.

Mittels des temperaturempfindlichen Proteins ist es möglich, durch die Temperatur zu bestimmen, wann eine Pflanze aus dem vegetativen Wachstum in das reproduktive Wachstum übergeht und Blüten bildet.
Bildquelle: © Dawid Skalec/wikimedia.org/CC BY-SA 4.0
Hintergrund ist, dass normalerweise ein Konzentrationsanstieg von CONSTANS den Übergang in die reproduktive Wachstumsphase einleitet. Bauen jedoch die spezifischen lt-Degrons genau jene unter dem Einfluss höherer Temperaturen ab, verzögert sich der Start der Blütenbildung entsprechend.
Synergien mit CRISPR/Cas
Der Nutzen der neuen Methode ergibt sich nicht nur in Zusammenhang mit der Erforschung von Genfunktionen, sondern auch mit Blick auf andere Bereiche. Zum einen sehen die Forscher ihre Idee als wichtige Ergänzung zu bestehenden Methoden wie CRISPR/Cas. Schließlich sei es das eine, Gene gezielt modifizieren zu können, etwas anderes, praktische Kontrollmöglichkeiten zur Ausprägung eines Phänotyps zur Hand zu haben. Die Kombination beider Methoden birgt ihrer Ansicht nach viele Synergien und neue Anwendungsmöglichkeiten.
Potenzial für die Biotechnologie
Auch ist das Potenzial in Bezug auf die Anwendung in der Biotechnologie nicht zu übersehen. Im Fokus stehen ein weiteres Mal die Trichome. Hintergrund ist, dass bestimmte Trichomarten in der Lage sind, biochemische Substanzen herzustellen wie z. B. ätherische Öle oder Harze. Den Forschern schwebt vor, diese künftig häufiger zur Herstellung biochemischer Verbindungen einzusetzen, an denen die Industrie Interesse hat.
Aus ihrer Sicht ist es nur eine Frage der Zeit, bis es möglich ist, mit Hilfe von lt-Degrons weitere Prozesse im Pflanzeninneren zu steuern, Phänotypen auszubilden, Biosynthesewege besser zu deregulieren (Metabolic Engineering) und Pflanzen als alternative Produktionsplattformen (Molecular Farming) zu optimieren. Beispielsweise zur Gewinnung rekombinanter Proteine für therapeutische Zwecke oder als Impfstoffbasis.
Quelle:
Faden, F. et al. (2016): Phenotypes on demand via switchable target protein degradation in multicellular organisms. In: Nature Communications, Vol. 7 (12202), doi:10.1038/ncomms12202.
Zum Weiterlesen auf Pflanzenforschung.de:
- Biopharming – Pflanzenbasierte Arzneimittelproduktion
- Klettverschluss am Blütenblatt
- Was CRISPR/Cas leisten kann
Titelbild: Mithilfe ihrer Methode gelang es den Forschern, u. a. die Trichomentwicklung bei Arabidopsispflanzen zu steuern. (Bildquelle: © Heiti Paves/ wikimedia.org/ CC BY-SA 3.0)
