Solaranlagen: Proteine statt Halbleiter
Photosystem 1 arbeitet in künstlicher Umgebung schneller als in der Natur

Solarzellen imitieren, was Pflanzen schon lange können: Sie wandeln Energie aus Sonnenlicht in chemische Energie um. (Bildquelle: © Uwe Schlick / pixelio.de)
Eingebettet in ein spezielles Redox-Hydrogel arbeitet das Photosystem I wesentlich schneller als in seiner normalen zellulären Umgebung. Es könnte somit zum nachwachsenden Rohstoff für die Solarzellindustrie werden.
Die Natur hat im Lauf der Evolution alle Prozesse in den Zellen optimiert. Alle? Nein. Hier und da gibt es noch Stellschrauben, an denen die Forscher die Effizienz einzelner Prozesse verbessern können. Eine dieser Stellschrauben ist das Photosystem I (PSI), das Teil der Photosynthese-Maschinerie von Pflanzen, Algen und Cyanobakterien ist, die damit Lichtenergie in chemische Energie umwandeln. Photosystem I hat die Aufgabe, angeregte Elektronen von Plastochinon auf Ferredoxin zu übertragen. Etwa 50 Elektronen pro Sekunde schafft ein Photosystem I normalerweise.

Cyanobakterien können in Süß- oder Salzwasser wachsen. Sogenannte "Algenblüten" können bei vermehrtem Auftreten entstehen, auch wenn Cyanobakterien nicht zu den Algen, sondern zu den Bakterien gezählt werden. Darüber hinaus sind sie in der Lage Photosynthese zu betreiben.
Bildquelle: © Christian Fischer/ wikimedia.org; CC BY-SA 3.0
Forschern von der Ruhr-Universität Bochum (RUB) ist es vor kurzem gelungen, diese Elektronentransfer-Rate in künstlicher Umgebung auf rund 335 Elektronen pro Sekunde zu steigern. „In Pflanzen sind die Photosysteme limitiert, in künstlicher Umgebung können wir das maximale aus Ihnen herausholen“, erklärt Matthias Rögner, Professor für Biochemie der Pflanzen an der RUB, der an der Studie beteiligt war. Die Entdeckung ist interessant für die Solarzellindustrie, denn eventuell könnte PSI eines Tages die Silizium-Halbleiter in Solarzellen ersetzen.
Hydrogel bietet dem Photosystem I die perfekte Umgebung
Normalerweise befindet sich das PSI in der Thylakoidmembran der Chloroplasten. Im Labor schufen die Wissenschaftler ihm eine Umgebung, die sich perfekt an die Bedürfnisse des riesigen Proteinkomplexes anpasst: ein Redox-Hydrogel. Es besteht aus Polymerketten, die große Mengen Wasser speichern können und deren Festigkeit sich durch den pH-Wert verändern lässt.
Im sauren Bereich ist das Hydrogel aufgequollen und die Photosysteme sind frei darin verteilt. Wechselt man in den basischen Bereich, wird das Gel starr und hält dadurch die Proteine in engem Kontakt mit der Elektrode. Elektronen können somit besonders effektiv übertragen werden. Die theoretisch berechnete Stromausbeute pro Quadratzentimeter „künstliches Blatt“ konnte durch diese Fixierung der Photosysteme vom Nanowatt-Bereich in den Mikrowatt-Bereich gesteigert werden. Das ist zwar eine gewaltige Steigerung, doch trotzdem kommen die halb-künstlich halb-natürlichen Sonnenkollektoren mit dieser Leistung noch lange nicht an siliziumbasierte Solarzellen heran.
Trotzdem sind die Forscher der Meinung, dass ihre Erfindung schon jetzt bei speziellen Anwendungen zum Einsatz kommen könnte. „Mit unserer Biophotovoltaik könnten wir intelligente Kontaktzellen mit Energie versorgen“, erklärt Dr. Nicolas Plumeré, Erstautor der Studie, der an der RUB die Nachwuchsgruppe Molekulare Nanostrukturen leitet. Solche Kontaktlinsen, die beispielsweise bei Diabetikern den Glukosegehalt der Tränenflüssigkeit messen oder den Augeninnendruck überwachen sollen, sind zurzeit in der Entwicklung. „Unser großes Ziel bleibt jedoch die Herstellung von günstigen und effizienten Solarzellen als Ersatz zu siliziumbasierten Photovoltaikanlagen“, sagt Plumeré.
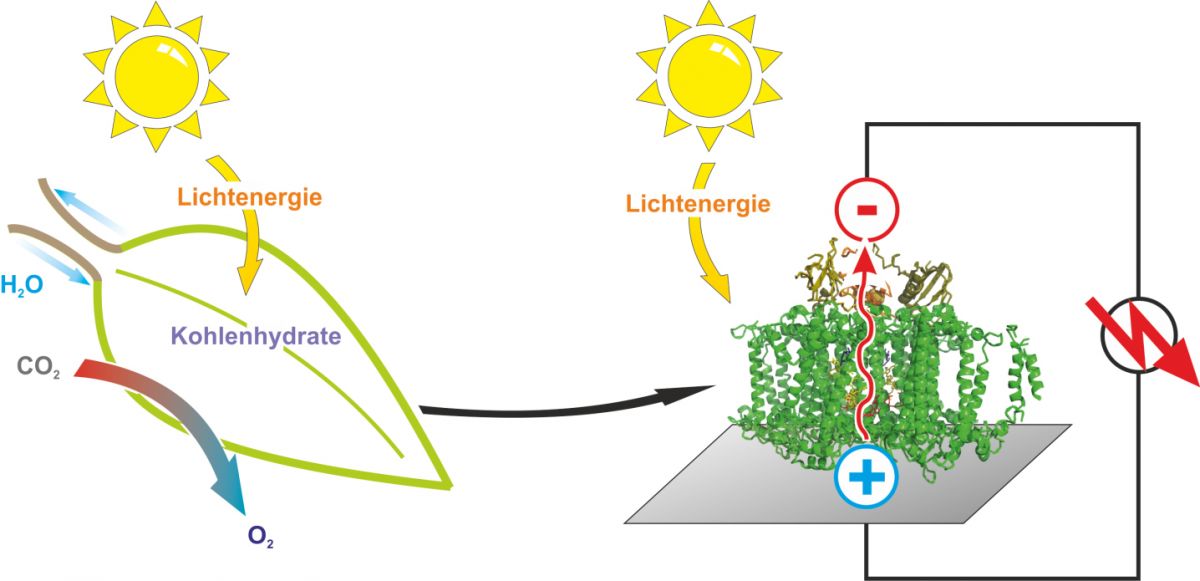
Während natürliche Blätter Lichtenergie in Biomasse umwandeln, wandeln Solarzellen sie in elektrischen Strom um.
Bildquelle: © Nicolas Plumeré
Cyanobakterien könnten Wasserstoff produzieren
Rögner hingegen sieht die Experimente als Vorarbeit um letztendlich Cyanobakterien dazu zu bringen, mit Hilfe von Sonnenlicht Wasser zu spalten und Wasserstoff als Treibstoff für Brennstoffzellen herzustellen. „Als grüne Energiequelle ist Wasserstoff die Lösung schlechthin, meiner Meinung nach gibt es keine Alternative“, sagt Rögner. Denn bei der Verbrennung von Wasserstoff entsteht anstatt des klimaschädlichen Treibhausgases Kohlendioxid nur: Wasser. Treibstoff in Cyanobakterien zu produzieren, hätte außerdem den Vorteil, dass keine Konkurrenz um Anbauflächen für Lebensmittel entstünde.
Damit aus herkömmlichen Cyanobakterien kleine Wasserstoff-Reaktoren werden, müssen die Forscher energiereiche Elektronen aus der Photosynthese abzweigen und auf das – extra zu diesem Zweck eingebaute – Enzym Hydrogenase übertragen, das dann den Wasserstoff produziert. Die meiste Energie haben die Elektronen direkt nachdem das Photosystem I sie auf Ferredoxin geleitet hat. „Dort liegt unser Angriffspunkt“, erklärt Rögner.
Er und sein Team arbeiten daran herauszufinden, wie viele Elektronen man den Cyanobakterien wegnehmen kann, ohne dass ihre Lebensfunktionen beeinträchtigt sind. „Wir denken, dass 25 Prozent der Elektronen unentbehrlich für die Cyanobakterien sind, aber dann blieben immerhin noch 75 Prozent für die Wasserstoffproduktion übrig.“
Quelle:
Kothe T, et al. (2014): Engineered Electron-Transfer Chain in Photosystem 1 Based Photocathodes Outperforms Electron-Transfer Rates in Natural Photosynthesis. In: Chem. Eur. J. Volume 20, Issue 35, 11029–11034, (25. August 2014), DOI: 10.1002/chem.201402585.
Zum Weiterlesen auf Pflanzenforschung.de:
- Lichterntemaschine nach dem Vorbild der Natur – Neue Bio-Solarzelle als Stromlieferant
- Mit künstlicher Photosynthese Energie gewinne
- Künstliche Blätter – Energiequellen der Zukunft
Titelbild: Solarzellen imitieren, was Pflanzen schon lange können: Sie wandeln Energie aus Sonnenlicht in chemische Energie um. (Bildquelle: © Uwe Schlick / pixelio.de)
