Was CRISPR/Cas leisten kann
Der Editierung von Genomen scheinen technologisch kaum noch Grenzen gesetzt
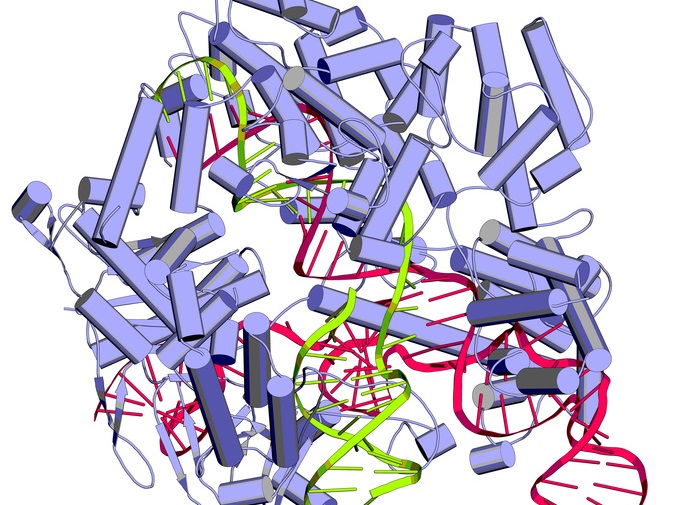
Die Kristallstruktur des Proteins Cas9 (violett) zusammen mit sgRNA (pink) und Ziel-DNA (grün). Die Nuklease Cas9 ist zurzeit das Hauptinstrument der Genom Editierung. (Quelle: © molekuul.be - Fotolia.com)
Das CRISPR/Cas9-System, ursprünglich als Verteidigungsmechanismus von Prokaryoten gegen Viren beschrieben, kann definierte DNA-Sequenzen gezielt angreifen und durchtrennen. Dieser einfache zelluläre Schutzmechanismus kann sehr einfach für technologische Zwecke umprogrammiert werden. Der folgende Beitrag beschreibt beispielhaft die Vielfalt der Anwendungen.
In einem Genom mit seinen Abermillionen Basenpaaren, die auf mehreren Chromosomen verteilt sind – wobei die Chromosomensätze auch noch in mehreren Kopien vorliegen können – eine bestimmte DNA-Sequenz aus wenigen Nukleotiden zu finden, entspricht der Suche nach der Stecknadel im Heuhaufen. Diese DNA-Sequenz dann gezielt umzuschreiben (zu editieren) und dabei, um im Bild zu bleiben, keinen anderen Grashalm im Heuhaufen zu verschieben, ist technologisch eine Meisterleistung.
Zellen beherrschen diese Meisterleistung von Natur aus. Dadurch schützen sie sich vor Eindringlingen und dem Umprogrammieren ihrer „Festplatten“, dem Genom. Versuche, diese Fähigkeit der Zellen zu nutzen, um die genetischen Informationen umzuschreiben, stießen bisher an Grenzen. Restriktionsenzyme und andere Nukleasen sind nicht universell einsetzbar. Sie können nur an bestimmten Erkennungssequenzen der DNA binden und diese schneiden. Die gezielte Veränderung dieser Enzyme mit Hilfe eines sogenannten Protein-Engineerings, um auch andere Sequenzen zu erkennen, ist kompliziert.
Anders und deshalb universeller funktioniert das CRISPR/Cas9-System. Es basiert auf den Paarungsregeln von Nukleotiden (RNA und DNA). Dadurch kann eine sogenannte „guide“ RNA (wie z. B. die sgRNA) das Cas9-Protein, ein an das CRISPR-System gekoppeltes Eiweiß, an jede beliebige DNA-Sequenz bringen. Ist an dieser Stelle eine PAM-Erkennungssequenz vorhanden, schneidet die Endonuklease die DNA.
Dank seiner Präzision wird das CRISPR/Cas-System als "genetische Chirurgie" oder Genom Editierung der dritten Generation bezeichnet. Für den Prozess muss nach dem Schneiden der DNA zwangsläufig der Doppelstrangbruch repariert werden.
Bildquelle: © iStock.com/wildpixel
Ausschneiden ohne Einfügen ist Unfug
Der DNA-Doppelstrangbruch ist aber nur der Anfang der Genom Editierung. Der „Heuhaufen“ muss schließlich wieder in Form gebracht werden. Für Lebewesen können DNA-Doppelstrangbrüche (Eng.: „double strand breaks“) wichtiger Gene tödlich sein. Aus diesem Grund besitzen Zellen von Haus aus Mechanismen, um diese zu reparieren. Ein bekanntes Beispiel ist die Reparatur von Strangbrüchen der DNA in Hautzellen nach einem Sonnenbad.
Zwei zelleigene Prozesse stehen für diese Reparaturaufgaben bereit: Zum einen das „non-homologous end joining“ (NHEJ) und zum anderen das „homologous directed repair“ (HDR). Für eine grobe Schnellreparatur von DNA-Brüchen steht das NHEJ zur Verfügung. Der Nachteil: Im Genom können bei einer solchen Schnellreparatur sogenannte „Indels“ (also Deletionen und/oder Insertionen) auftreten, so dass die Erbsubstanz an der Bruchstelle nicht mehr dem Original entspricht. Auch Punktmutationen einzelner Basenpaaren können auftreten.
Der HDR-Mechanismus arbeitet hingegen „feinfühliger“. Für die Reparatur wird eine homologe, also eine identische DNA-Sequenz, als Vorlage verwendet. Als Vorlage bei diploiden Organismen, wie z. B. dem Menschen, dient die DNA-Sequenz auf dem gepaarten Chromosom. Mit der Information der homologen DNA-Sequenz wird die als beschädigt erkannte Information fehlerfrei überschrieben. Zellen verwenden die beiden Reparaturmechanismen meistens auf einer "entweder-oder" Basis.
Präzise Genom Editierung durch überarbeitete DNA
Verursacht ein Cas9/sgRNA-Komplex einen DNA-Doppelstrangbruch, versucht man den HDR-Prozess entweder durch Hemmung des NHEJ-Prozesses oder durch Zugabe einer homologen DNA-Sequenz (oder beidem) zu begünstigen. Somit können Forscher eine einzige oder sogar mehrere Punktmutationen im Genom umschreiben. Möglich ist auch, ganze DNA-Abschnitte präzise zu entfernen (Erzeugung von sogenannten Knock-Outs-Organismen) bzw. einzufügen (Erzeugung von cisgenen- oder transgenen-Organismen).
Cas9 ist außerdem in der Lage, mehrere DNA-Abschnitte zeitgleich zu erkennen, solange die zu der DNA komplementären sgRNAs in der Zelle vorhanden sind. Dies ist eine Eigenschaft, die für das sogenannte Multiplexing Voraussetzung ist. Durch das Multiplexing können mehrere Gene gleichzeitig umgeschrieben werden (s. unten).

CRISPR/Cas9 funktioniert auch in Pflanzen sowie in weiteren Eukaryoten. Durch die leichte Handhabung des Systems und das Multiplexen wurde im Labor das hexaploide Genom des Weizens erfolgreich editiert, was mit den bisherigen Methoden nicht möglich war.
Bildquelle: © Eugen Stabb / wikipedia.org; gemeinfrei
Auch in Pflanzen, Tieren & Co. funktionsfähig
Für die Anwendung des CRISPR/Cas-Systems ist vor allem von Bedeutung, dass es auch in Eukaryoten funktioniert. Damit dies gelingt müssen sowohl Cas9 als auch sgRNA in den Organismus eingebracht und anschließend in der Zelle in den Zellkern transportiert werden.
Neuere Studien zeigen, dass diese bisherige Hürde umschifft werden kann. Dies geschieht entweder durch (i) die Einführung der entsprechenden Gene in die Wirtszelle (also DNA, die die Informationen für die Herstellung von Cas9 und sgRNA in sich trägt) oder (ii) das direkte Einspritzen von Cas9 und sgRNA. Beim ersteren Fall, der zurzeit am meisten benutzt wird, wird die Wirtszelle mit fremden genetischen Informationen verändert. Beim letzteren Fall wird die Zelle transient mit den Cas9 und sgRNA versorgt. Somit ist dieses Szenario einer neuen Studie zufolge attraktiver, denn die Wirtszelle wird nicht genetisch manipuliert, sondern biochemisch.
Eine bunte Palette von Anwendungsmöglichkeiten
Eine Vielzahl von Studien zeigt das riesige Potential des CRISPR/Cas9-Systems für die Grundlagenforschung. Das Erbgut wichtiger Modellorganismen deren Genome bislang schwer verändert werden konnten, hierzu zählt zum Beispiel der Hefepilz Candida albicans, konnte dank CRISPR/Cas erfolgreich verändert werden.
Das Gleiche gilt für polyploide Organismen (d. h. Organismen mit mehreren Chromosomensätzen). Waren diese mit „klassischen“ Methoden der Molekularbiologie nur schwer zu verändern, ist dies durch das Multiplexen von CRISPR/Cas nun in einem Schritt möglich. Einer Studie zufolge konnten so erstmalig alle sechs Kopien eines Gens in Weizen gleichzeitig um lediglich einige Nukleotide verändert und dieser resistent gegen den gefürchteten Mehltaupilz gemacht werden. Eine solche widerstandsfähige Sorte wäre in der landwirtschaftlichen Praxis nützlich. Diese würde Ertragsmengen und Qualität sichern und den Einsatz von Pflanzenschutzmitteln reduzieren helfen.
Aber auch in der Humanmedizin werden neue Anwendungen der Genom Editierung diskutiert. Grundsätzlich unterscheidet man zwischen in vivo und ex vivo-Ansätzen. Beim Letzteren werden Zellen aus dem Körper entnommen, behandelt und wieder eingefügt. Beispielsweise wird versucht, weiße Blutzellen von HIV-infizierten Menschen im Labor gegen das Virus widerstandsfähig zu machen. Dies erfolgt indem man mit CRISPR/Cas9 die Eintrittspforte (das Rezeptor-Protein) für das HI-Virus abschaltet. Die so entstandenen "geschützten" Immunzellen würden dann die anfälligen weißen Blutzellen im Körper verdrängen und könnten eine Resistenz gegen HIV bewirken.
Bei den in vivo-Ansätzen geschieht die Genom Editierung ohne Zellen aus dem Organismus zu entnehmen. Dies kann im vollentwickelten Körper geschehen, zum Beispiel um geschädigte Gene bzw. erworbene Mutationen zu korrigieren. Aber auch Keimbahntherapien könnten so zumindest technologisch möglich sein. Dabei werden Spermienzellen, Eizellen oder befruchtete Eizellen mit Hilfe von CRISPR/Cas gezielt verändert. Gene für Erbkrankheiten könnten umgeschrieben werden. Allerdings setzt dies voraus, dass gleichzeitig Nebenwirkungen wie „off-target cuts“ (siehe unten) verhindert werden. Solche Eingriffe, obschon bereits im Labor getestet, sind in einigen Ländern gesetzlich verboten. Deutschland zählt zu diesen Ländern. Aber auch unter den Wissenschaftlern haben diese technologischen Möglichkeiten eine breite Debatte angestoßen. In der Öffentlichkeit werden diese einerseits ob ihrer Möglichkeiten gefeiert, stoßen aber auch auf Kritik und Widerstand.
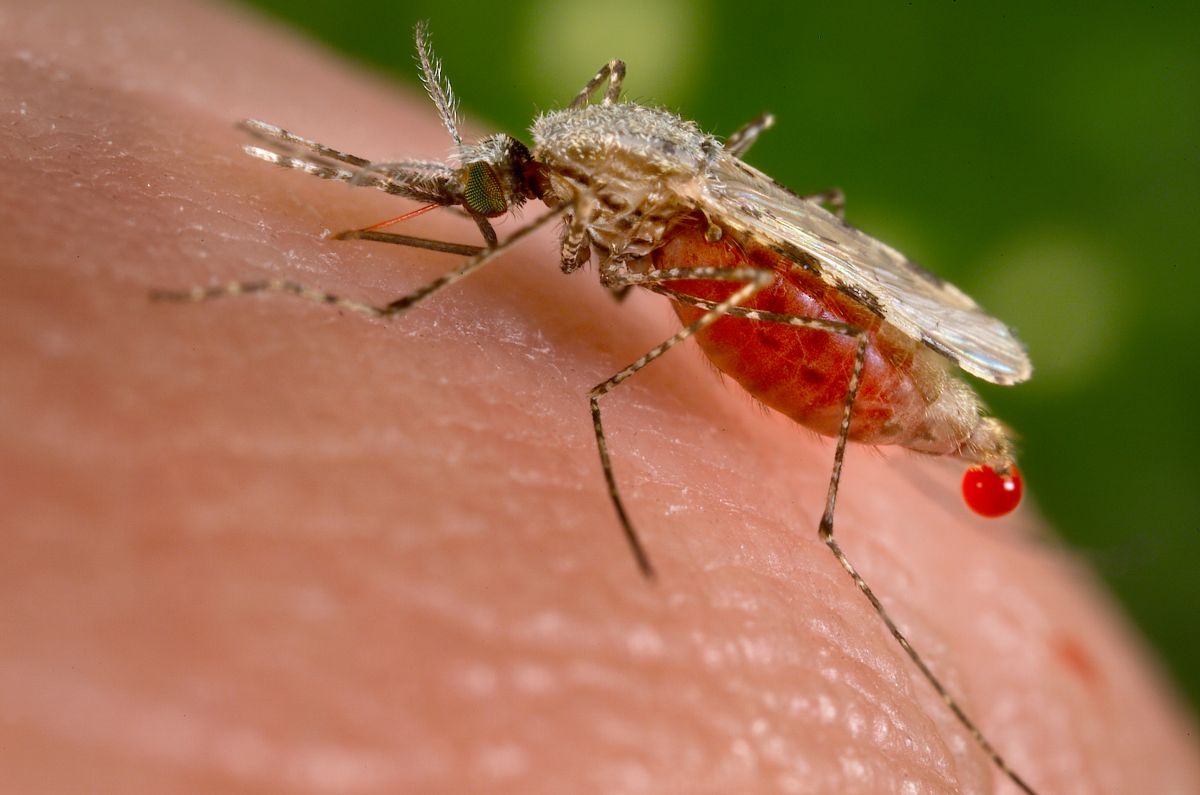
Mit CRISPR/Cas9 kann man das Genom der Anopheles-Mücken editieren. Durch den sogenannten "Gene Drive" versuchen Forscher, die Übertragung der Malaria-Erreger durch die Mücken zu unterbinden. Die Änderung der genetischen Informationen in einer Population bringt auch unvorhersehbare Konsequenzen für das Ökosystem mit sich.
Bildquelle: © Jim Gathany, CDC / wikipedia.org; gemeinfrei
Altbekannte Regeln auf den Kopf gestellt
Eine weitere, mögliche Anwendung für das CRISPR/Cas9-System ist es, Gene in Populationen einzubringen oder auszuschalten, um die genetische Disposition dieser Population zu verändern. Der Prozess wendet eine genetische Veränderung im Labor an, um die klassischen Mendelschen Vererbungsregeln auf den Kopf zu stellen.
„Gene Drive“ wird dies genannt. „Gene Drive“-Ansätze gibt es schon länger. Die CRISPR/Cas9-Technologie ist allerdings in der Lage, den „Gene Drive“ zu beschleunigen. Bei der Methode wird mithilfe von CRISPR/Cas9 beispielsweise ein Gen ausgeschaltet. Die Gendeletion springt dann von Chromosom zu Chromosom und wird an alle Nachkommen vererbt. Ist diese Veränderung gleichzeitig mit einem anderen Vorteil gekoppelt oder wird eine entsprechend große Zahl von Individuen genetisch verändert und in die Natur entlassen, würde sich dieses Merkmal in der gesamten - zumindest aber in einem großen Teil der - Population ausprägen.
Am Beispiel gentechnisch veränderter Mücken, die nicht in der Lage sind, Malaria-Parasiten zu übertragen, wurde über Möglichkeiten aber auch Risiken dieser gezielt in Umlauf gesetzten Genvarianten diskutiert.
Innovation durch Präzision und Einfachheit
Die zugrunde liegenden Prozesse und Verfahren der Genom Editierung sind nicht neu. Die Präzision, Schnelligkeit und Wirtschaftlichkeit der CRISPR/Cas9-Technologie ist jedoch beispiellos.
Außerdem sind Markergene in dem Prozess nicht mehr notwendig. Markergene sind mit dem Zielgen gekoppelt und lösen leicht erkennbare und damit selektionsfähige Eigenschaft aus. Dies können z. B. Resistenzen gegenüber Antibiotika oder Herbiziden sein. Überleben die Zellen den Selektionsdruck bei der Anzucht, kann mit großer Sicherheit davon ausgegangen werden, dass sie im Experiment erfolgreich verändert wurden. Markergene waren in der Vergangenheit eines der Hauptargumente von Kritikern der Gentechnik. Man befürchtet eine Integration dieser in das Erbgut anderer Bakterien oder Pflanzen, die falls es Krankheitserreger oder Unkräuter sind, dann schwerer zu bekämpfen sind.
Das System kann verbessert werden
Zurzeit versuchen Forscher, die hohe Spezifizität des Systems zu gewährleisten und sogenannte „off-target cuts“ zu minimieren - also eine Durchtrennung des Erbgutes außerhalb des gewünschten Bereiches. Dies verfolgen Wissenschaftler unter anderem mit Fusionsproteinen (Cas9 mit FokI). FokI sind Nukleasen, die durch Dimer-Bildung funktionsfähig sind. Dies erfordert eine Art Doppelerkennung der DNA, was „off-target cuts“ vermindert. Weitere Aspekte wie zum Beispiel Stabilität bzw. optimale Konzentration von Cas9 und sgRNA für das Genome Editing werden zurzeit untersucht.
Auch bei der Behandlung einer HIV-Virus-Infektion könnte die CRISPR/Cas9-Technologie eingesetzt werden. Man arbeitet daran, die Eintrittspforte - durch die das Virus eindringt - in den weißen Blutzellen mithilfe der Genom Editierung abzuschalten, damit die modifizierten Zellen resistent gegen das Virus werden.
Bildquelle: © Hans R. Gelderblom und Andrea Schnartendorff, Robert-Koch-Institut
Auch entdeckten Forscher um Feng Zhang weitere Cas-Proteine, die die Werkzeugkiste der Genom Editierung erweitern. Das Enzym Cpf1 beispielsweise erkennt eine andere PAM-Sequenz als Cas9, schneidet DNA in versetzter Weise und benötigt eine kürzere sgRNA als Cas9. Zudem ist das Protein Cpf1 kleiner als Cas9. Das hätte die Vorteile, dass (i) Cpf1 und sgRNA leichter in die Wirtszelle eingefügt werden könnten, (ii) dank der neuen PAM auch neue DNA-Sequenzen erkannt werden könnten und (iii) dank des versetzten DNA-Bruchs der präzise Reparaturprozess (HDR) erleichtert werden würde.
Streit um die Patentierung
Die Reichweite und die technischen Möglichkeiten des CRISPR/Cas9-Systems führten dazu, dass mehreren Start-Up-Unternehmen rund um die Technologie entstanden sind. CRISPR Therapeutics, Editas Medicine oder Intellia Therapeutics sind nur einige Beispiele. Gleichzeitig ist um die Verwertungsrechte zwischen den Erfindern des Systems bereits ein Konflikt entbrannt.
Wie diese Konflikte gelöst und wie sich die Anwendungsmöglichkeiten des CRISPR/Cas9-Systems entfalten werden, wird man in Laufe der nächsten Jahre erfahren. Die Geschwindigkeit des Fortschritts der Technologie und die vielfältigen Anwendungsmöglichkeiten der Genom Editierung versprechen ein breites Spektrum von der Grundlagenforschung bis hin zur Anwendung. Im Agrarbereich sprechen Unternehmen wie DuPont Pioneer-Hi-Bred International davon, in den nächsten fünf bis zehn Jahren erste CRISPR/Cas editierten Pflanzen auf dem Markt zu haben. Diese sollen resistent gegen Trockenheit, weniger anfällig gegen Schädlinge oder für die Hybridzüchtung geeignet sein. So hofft man, mit CRISPR/Cas auch beim Weizen die Hybridzüchtung zu etablieren und dadurch die seit Jahren stagnierenden Erträge massiv zu steigern, so dass diese mit den Erfordernissen einer wachsenden Weltbevölkerung Schritt halten können.
Obwohl solche Pflanzen im Labor gezielt verändert werden würden, wären sie aber dank der Präzision des CRISPR/Cas9-Systems und der Abwesenheit von Markergenen nicht zwingendermaßen als GVO zuordenbar. Wie die Technologie in die Zukunft eingesetzt wird hat nicht nur mit den wissenschaftlichen Fortschritten zu tun. Auch Politik, Gesellschaft, Konzerne und NGOs werden mit Sicherheit in der Meinungsbildung und Regelung der Technologie eine große Rolle spielen. Zu hoffen ist, dass sowohl die Chancen als auch mögliche Risiken der Technologie mithilfe von neutral erarbeiteten und fachlich fundierten Argumenten diskutiert werden. Zu hoffen bleibt, dass die Lehren aus anderen Technologiedebatten gezogen wurden und die Genom Editierung nicht als bloßes Kampagnenmaterial in die eine oder andere Richtung benutzt wird.
Quellen:
- Hsu, P.D. et al. (2014): Development and applications of CRISPR-Cas9 for genome engineering. In: Cell 157(6):1262-78 (5. Juni 2014), doi:10.1016/j.cell.2014.05.010.
- Bortesi, L. & Fischer, R. (2014): The CRISPR/Cas9 system for plant genome editing and beyond. In: Biotechnology Advances 33:41-52 (20. Dezember 2014), doi:10.1016/j.biotechadv.2014.12.006.
- Gantz, V.M. & Bier, E. (2015): The mutagenic chain reaction: A method for converting heterozygous to homozygous mutations. In: Science 348(6233):442-4 (10. März 2015), doi:10.1126/science.aaa5945.
- Wang, Y. et al. (2014): Simultaneous editing of three homoeoalleles in hexaploid bread wheat confers heritable resistance to powdery mildew. In: Nature 32(9):947-52 (20. Juli 2014), doi:10.1038/nbt.2969.
- Zetsche, B. et al. (2015): Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. In: Cell 163:1-13 (22. Oktober 2015), doi:http://dx.doi.org/10.1016/j.cell.2015.09.038.
- Woo, J.W. et al. (2015): DNA-free genome editing in plants with preassembled CRISPR-Cas9 ribonucleoproteins. In: Nature Biotechnology [Epub ahead of print] (19. Oktober 2015), doi:10.1038/nbt.3389.
Zum Weiterlesen auf Pflanzenforschung.de:
- Wie CRISPR/Cas funktioniert – Eine einfache Technologie verbessert die Effizienz der Genom Editierung
- Gibt es neben Chancen auch Risiken von CRISPR/Cas9? Der Nutzen der Genom Editierung hängt davon ab, wie die Gesellschaft damit umgeht
- Passgenaues Immunsystem in Pflanzen – Forschern gelingt Virusabwehr mit CRISPR
- Lexikonbeitrag zum Genome Editing
- Factsheet: Das CRISPR/Cas-System
Weiterführende Informationen:
- New Scientist (2015): Interview mit Emmanuelle Charpentier:"We have a duty to use my gene-editing technology responsibly"
- ZKBS (2016): Stellungnahme der ZKBS zur Einstufung von gentechnischen Arbeiten zur Herstellung und Verwendung von höheren Organismen mit rekombinanten Gene-Drive-Systemen
- Deutscher Naturschutzring e.V. (2016) Aufschub für gefährliche Gentechnikmethode
Titelbild: Die Kristallstruktur des Proteins Cas9 (violett) zusammen mit sgRNA (pink) und Ziel-DNA (grün). Die Nuklease Cas9 ist zurzeit das Hauptinstrument der Genom Editierung. (Quelle: © molekuul.be - Fotolia.com)
