Zwei Fliegen mit einer Klappe
Vor Bakterien und Trockenheit schützen sich Pflanzen mit dem gleichen molekularen Mechanismus
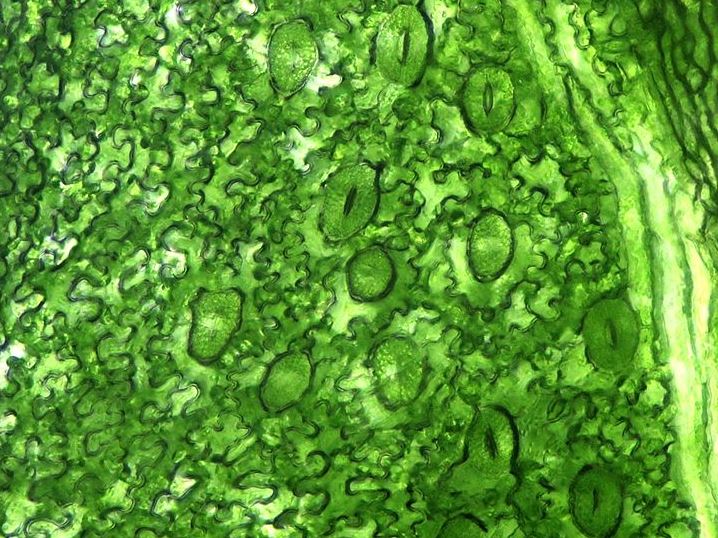
In Blättern befinden sich sehr viele kleine Poren, die sich öffnen oder verschließen lassen. Sie bergen aber ein Risiko: Für Bakterien sind sie willkommene Schlupflöcher, um in die Pflanzen einzudringen. (Bildquelle: © Micropix/wikimedia.org/CC BY-SA 3.0)
Dass Pflanzen bei Trockenheit und Befall durch Bakterien die Poren in ihren Blättern schließen, ist schon lange bekannt. Dass das Schließen aber durch den gleichen molekularen Mechanismus ausgelöst wird, konnten kürzlich Forscher der Universität Würzburg zeigen. Nur ein Enzym ist notwendig, um gegen beide Stressoren gewappnet zu sein. Für die Kulturpflanzenforschung heißt das: In der Züchtung spielt das Enzym OST1 eine besondere Rolle, denn es macht die Pflanze nicht nur tolerant gegenüber Trockenstress, sondern auch widerstandsfähiger gegenüber Schädlingen.
Wird es einer Pflanze zu trocken, so schließt sie die Poren an der Unterseite ihrer Blätter, durch die sie normalerweise Kohlendioxid aus der Luft aufnimmt. Dadurch verhindert sie weitere Transpiration. Je zwei Schließzellen bilden eine Pore (Stoma) zwischen sich und halten diese abhängig vom Druck im Zellinneren entweder geöffnet oder geschlossen. Steigt der Innendruck (Turgor), dehnen sich die Zellen aus und ziehen die verhärteten gegenüberliegenden Kanten nach – die Pore öffnet sich. Sinkt der Druck, so schrumpft die Zelle, die Kanten „entspannen“ und verschließen die Pore. Die Veränderung des Turgors unterliegt dem Prinzip der Osmose, also dem Strömen von Molekülen durch eine selektiv durchlässige Membran zum Ausgleich eines Konzentrationsunterschiedes. Der Molekülstrom wird durch spezifische Ionenkanäle reguliert, die geöffnet oder geschlossen werden können. Das klingt zunächst einfach – dahinter steckt aber ein komplexer Signalweg.
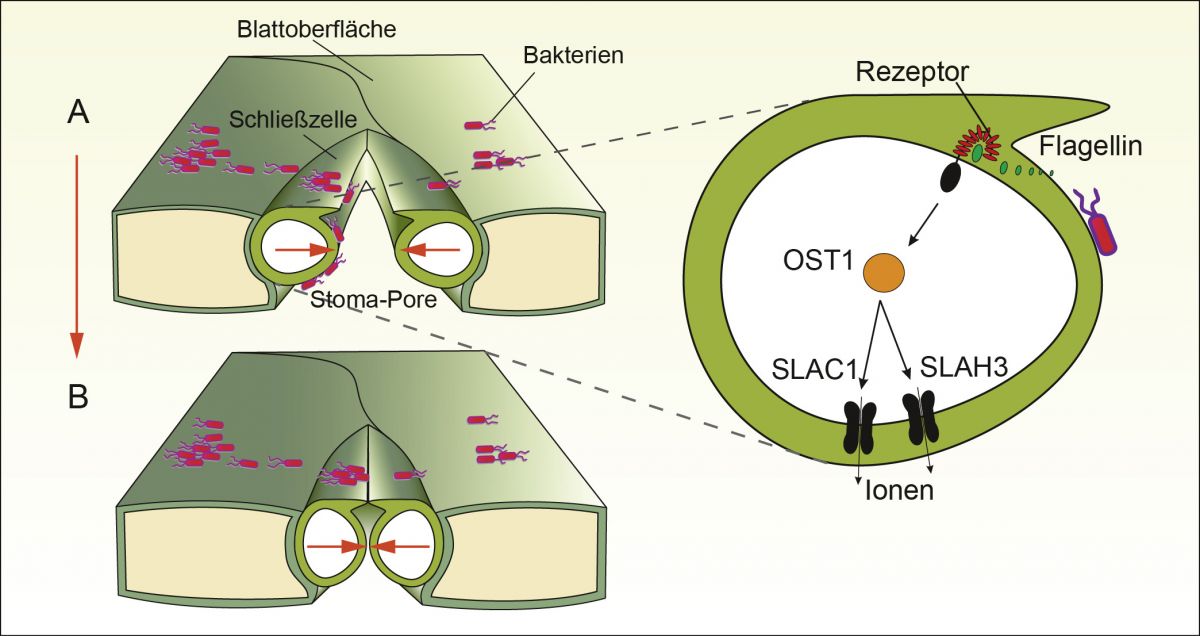
Bakterien nutzen Poren als Schlupflöcher, um ins Blattinnere zu gelangen (A). Die Pflanze reagiert, indem sie die Ionenkanäle SLAC1 und SLAH3 aktiviert (r). Die Poren schließen sich.
Bildquelle: Grafik: Rob Roelfsema
Sobald den Wurzeln im Boden nicht mehr ausreichend Wasser zur Verfügung steht, produziert die Pflanze das Stresshormon ABA (abscisic acid, Abscisinsäure) und transportiert es in die Schließzellen. Hier aktiviert das Hormon die Produktion des Enzyms OST1, das wiederum den Anionenkanal SLAC1 öffnet. Die hohe ABA-Konzentration erlaubt es außerdem, dass ein weiteres Protein den Kanal SLAH3 öffnet. Die an der Öffnung beteiligten Proteine schließen den Ionenkanal buchstäblich auf, indem sie gemäß dem Schlüssel-Schloss-Prinzip an einen spezifischen Rezeptor binden. Der Turgor sinkt, die Zellen schließen die Pore.
Für Bakterien der Schlüssel zum Eigentor
Bakteriellen Schädlingen sind die Stomata willkommene Eingangstore. Kein Wunder also, dass Pflanzen im Gegenzug innerhalb von Minuten nach einem Befall ihre Poren schließen. Doch wie kann ein Bakterium den gleichen Schutzmechanismus in Gang setzen, den auch der Mangel an Wasser auslöst? Die Antwort liegt, wie das Forscherteam um Aysin Guzel Deger an der Universität Würzburg zeigen konnte, in dem molekularen Schlüssel, für den es in der Membran der Schließzelle das passende Schloss gibt. Nicht nur das pflanzeneigene Enzym OST1 können Membranproteine wie Ionenkanäle erkennen. Auch Moleküle, die Schädlinge an sich tragen und sie als Gefährdung kennzeichnen, werden erkannt. Zu diesen „microbe associated molecular patterns“ (MAMPs) gehört das Proteinfragment flg22.
Die Kette aus 22 Aminosäuren ist die Hauptkomponente des schweifartigen Anhängsels (Flagellums) des Bakteriums Pseudomonas syringae. Sobald das Bakterium die Pflanze befallen hat und in ausreichender Konzentration in der Atemhöhle vorhanden ist, bindet flg22 an ein rezeptorähnliches Protein (FLS2) in der Membran der Schließzelle, das die Funktion hat, Prozesse zu aktivieren. Es initiiert daraufhin die Interaktion zweier weiterer Proteine im Inneren der Zelle, wodurch schließlich das Enzym OST1 aktiviert wird. Über Umwege löst flg22 so die Regulation des Turgors der Schließzelle aus - das Bakterium verschließt also seinen eigenen Kollegen die Tür.

Die Ackerschmalwand Arabidopsis thaliana ist die wohl bedeutendste Modellpflanze der Genomforschung. Auch hier diente sie den Forschern als Versuchspflanze.
Bildquelle: © Pflanzenforschung.de
Nanofusionen und Mikroelektroden
Diesen Beobachtungen unterliegen umfangreiche Experimente an der bewährten Modellpflanze Arabidopsis thaliana (Ackerschmalwand). Um die Wirkung des Trockenstresshormons ABA und der feindlichen Aminosäurekette flg22 zu vergleichen, injizierte man der Pflanze beide Substanzen sowie eine Kontrollsubstanz und maß zunächst die Verzögerung, mit der die Pflanze ihre Poren schließt, und die Geschwindigkeit in der dies passiert. Dazu legten die Forscher den Versuchspflanzen Nanofusionen: Über die Spitzen von Glaskapillaren mit einem Durchmesser von einem Mikrometer flößten sie den Pore hochkonzentrierte ABA - bzw. flg22 - sowie zur Kontrolle eine Puffersubstanz ein.
Unter dem Mikroskop ließ sich an den benachbarten Schließzellen die Reaktion ablesen. Darüber hinaus wollte man wissen, welcher Ionenkanal bei welcher Infusion geöffnet wird. Da die Moleküle, die durch die Ionenkanäle strömen, positiv oder negativ geladen sind, lässt sich mithilfe von Mikroelektroden die Spannungsänderung im Inneren der Zelle messen, sobald ein Kanal geöffnet wird.
Mutanten zum Vergleich
Um in beiden Verfahren gezielt die Ionenkanäle SLAC1 und SLAH3 beobachten zu können und die an den Schritten der Wirkungskette beteiligten Proteine zu identifizieren, verwendete man neben intakten Pflanzen auch eine Reihe von Mutanten. Mutante eins fehlten beide Ionenkanäle und Mutante zwei fehlte das rezeptorähnliche Membranprotein, an das flg22 bindet. Den weiteren Mutanten fehlten jeweils ein oder mehrere Enzyme, die am Signalweg von ABA beteiligt sind. Reagierten diese auch auf flg22, so konnte man rückverfolgen, an welchem Schritt sich beide Wirkungsketten überlappen – bei der Aktivierung des Enzyms OST1.
Bedeutung für Kulturpflanzenforschung
Trockenheit und Schädlinge sind zwei Hauptfaktoren, die Pflanzen das Leben schwer machen und für Einbußen in der Kulturpflanzenproduktion sorgen. Deshalb könnte das Enzym OST1 in Zukunft eine wichtige Rolle in der Züchtung widerstandsfähiger Pflanzen einnehme: Es macht sie tolerant gegenüber Trockenheit und gleichzeitig resistent gegenüber Schädlingen – und könnte so dazu beitragen, Erträge zu sichern.
Quelle:
Guzel Deger, A. et al. (2015): Guard cell SLAC1-type anion channels mediate flagellin-induced stomatal closure. In: New Phytologist, (30. April 2015), doi: 10.1111/nph.13435.
Zum Weiterlesen:
- Ahnenforschung zur Trockentoleranz
- Angriffspunkte für Insektizide identifiziert
- Bakterien kapern Pflanzenabwehr
Titelbild: In Blättern befinden sich sehr viele kleine Poren (die Stomata), die sich öffnen oder verschließen lassen. Sie bergen aber ein Risiko: Für Bakterien sind sie willkommene Schlupflöcher, um in die Pflanzen einzudringen. (Bildquelle: © Micropix/wikimedia.org; CC BY-SA 3.0)
