09.02.2009
Forschung Live
Plastidentransformation
„Wir entwickeln keine Produkte. Wir testen aus, was wissenschaftlich machbar ist.“
Plastiden - das sind eigenständige Einheiten in der Pflanzenzelle, die Erbinformation, also DNA, enthalten. In den Fokus der Forschung gelangten sie vor etwa 15 Jahren, als an der Modellpflanze Tabak zum ersten Mal eine gentechnische Veränderung der DNA in den Plastiden gelang. Heute wird weltweit daran geforscht, die Plastidentransformation bei landwirtschaftlichen Nutzpflanzen anzuwenden. Was diese Methode so interessant macht, darüber sprach bioSicherheit mit Ralph Bock und Mitarbeiterinnen seines Teams vom Max-Planck-Institut für molekulare Pflanzenphysiologie in Potsdam-Golm.
Prof. Dr. Ralph Bock vom Institut für molekulare Pflanzenphysiologie am Max-Planck-Institut (MPI) in Potsdam-Golm im Gespräch mit bioSicherheit

Melanie Oey erläutert den Ablauf in der Klimakammer, wo gentechnisch veränderte Tabakblätter in mehreren Schritten auf Antibiotika-haltigem Nährmedium zu kleinen Pflanzen herangezogen werden.

Es überleben nur die Pflanzen, die erfolgreich transformiert wurden.

Transgene Tabakpflanze

Tabakpflanzen im Gewächshaus
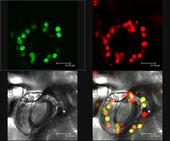
Mikroskopaufnahme einer Schließzelle von einer Tabakpflanze, in deren Plastiden ein Gen für ein fluoreszierendes Protein (GFP) eingebracht wurde. oben links : grüne GFP-Fluoreszenz, oben rechts: Natürliche Fluoreszens des Chlorophylls (rot), unten links: Hellfeldaufnahme der Zelle mit kugeligen Strukturen, den Chloroplasten, unten rechts: Überlagerung der Aufnahmen
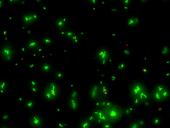
Für den Menschen gefährliche Streptokokken-Bakterien, 40-fache Auflösung
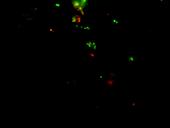
Die Streptokokken 30 Minuten nach Zugabe von 150 µg gesamtlösliches Protein aus einer Tabakpflanze, die aufgrund der gentechnischen Veränderung der Plastiden den antibakteriellen Stoff Lysin produziert, 100-fache Auflösung (grün= lebend, rot= abgestorben, vollständig lysierte Bakterien nicht mehr anfärbbar)
Etwas verloren in der Landschaft wirken die fünf dreistöckigen Gebäude des Wissenschaftsparks Golm vom nahe gelegenen Bahnhof aus betrachtet. Das ändert sich jedoch beim Näherkommen: Glasfassaden, großzügige Innenhöfe mit modernen Skulpturen vermitteln Transparenz und Offenheit. Dieser Eindruck bestätigt sich bei der Führung durch die Arbeitsräume, in denen Ralph Bock und seine Mitarbeiter High-Tech-Forschung zu Methoden der Gentechnik an Pflanzen betreiben. Das Besondere: Sie verändern nicht das Genom im Zellkern, sondern das Erbgut der Plastiden. In einer Pflanzenzelle gibt es neben dem Kerngenom zwei weitere Genome: in den Mitochondrien, die die Zelle mit Sauerstoff versorgen, und in den Chloroplasten (Plastiden), die für die Photosynthese zuständig sind.
Es geschah vor einer Milliarde Jahren
Die Vorläufer von Mitochondrien und Plastiden waren freilebende Bakterien. Vor mehr als einer Milliarde Jahren wurde zunächst ein Proteobakterium von der Zellmembran einer „Urzelle“ erst umschlossen, dann vollständig in das Innere aufgenommen und dort schließlich umfunktioniert. Die neue Aufgabe lautete Energiegewinnung durch Atmung. Bei der Entstehung von Pflanzenzellen wiederholte sich die Vereinnahmung eines Bakteriums dann ein weiteres Mal. Eine Blaualge, die schon damals Licht in chemische Energie umwandeln konnte, bot sich an. Weitere Zellorganellen waren entstanden: die heutigen Chloroplasten.
Im Verlauf der Evolution wanderten dann riesige Mengen der DNA aus den Organellen in das Kerngenom. Heute enthält eine Chloroplasten-DNA nur noch wenige Gene: in der Tomate sind es gerade mal 130 Gene im Gegensatz zum Kerngenom mit über 30.000 Genen.
Zwar ist die Anzahl der Gene in den Plastiden (Chloroplasten) gering, jedoch enthält jede Pflanzenzelle bis zu einhundert Plastiden, die wiederum bis zu einhundert identische DNA-Kopien enthalten. Werden in eine Plastiden-DNA neue Gene eingebracht, dann sind alle Kopien davon gleichzeitig aktiv. Dadurch kann eine Plastiden-DNA bis zu vierzig Prozent mehr Protein bilden, als eine DNA im Zellkern. Das macht die Plastidentransformation so interessant für biotechnologische Anwendungen. Melanie Oey, Doktorandin in der Forschungsgruppe um Ralph Bock, berichtet von ersten Ergebnissen bei der Herstellung eines antibiotisch wirkenden Proteins in Tabakpflanzen mit Hilfe der Plastidentransformation. „Bis zu 70 Prozent des gesamten Proteins der Pflanze ist antibiotischer Wirkstoff“, erklärt sie begeistert.
Biologisch sicher durch mütterliche Vererbung?
Plastiden verfügen über eine Besonderheit: ihre Gene werden in den meisten Pflanzen mütterlicherseits vererbt, d.h. der (männliche) Pollen dieser Pflanzen enthält kein Plastiden-Erbgut. Bei einer gentechnischen Veränderung der Plastiden finden sich die neuen Gensequenzen wegen der besonderen Vererbung also nicht in den Pollen wieder. Das Risiko einer unerwünschten Ausbreitung könnte mit dieser Strategie auf ein Minimum reduziert werden (biologisches Confinement). Ob dies tatsächlich funktioniert oder nicht doch gelegentlich Plastiden-Erbgut im Pollen zu finden ist, das haben Ralph Bock und sein Team versucht herauszufinden. Dazu haben sie unveränderte Pflanzen als weibliche Kreuzungspartner mit dem Pollen von Tabakpflanzen mit gentechnisch veränderten Chloroplasten bestäubt und die Nachkommen von etwa zwei Millionen Samen untersucht. Das Ergebnis: die Verbreitung von Transgenen aus Chloroplasten über Pollen ist sehr gering, die Wahrscheinlichkeit liegt bei weniger als einem Fünfzigtausendstel.
Eine weitere Frage hat die Potsdamer Wissenschaftler in den letzten Jahren beschäftigt: Können Gene aus den Plastiden in den Zellkern gelangen? In sehr großen evolutionären Zeiträumen könne dies tatsächlich passieren, erklärt Ralph Bock. Aber auch hier konnten er und seine Mitarbeiter zeigen, dass das Risiko sehr gering ist.
Soweit die Ergebnisse im Gewächshaus unter Standardbedingungen. Fraglich ist nun, ob diese Ergebnisse auch auf Freilandbedingungen übertragbar sind. Stressfaktoren in der Umwelt könnten einen Einfluss auf die Vererbung über Pollen bzw. auf den Transfer von Genen aus den Plastiden in den Zellkern haben. In Ralph Bocks aktuellem Projekt werden daher Tabakpflanzen mit verändertem Plastidengenom anbaurelevanten Stressbedingungen wie Hitze, Kälte oder Trockenheit ausgesetzt.
Getreide – die große Herausforderung
Für die Tomate haben Ralph Bock und seine Mitarbeiter bereits eine Plastidentransformations-Technologie entwickelt, einer anderen Arbeitsgruppe ist dies für Baumwolle gelungen. Aber die wirklich große Herausforderung bestehe immer noch in der Anwendung der Technologie bei den wichtigsten landwirtschaftlichen Nutzpflanzen, also den Getreidearten Weizen, Reis und Mais, so Ralph Bock.
Die Plastidentransformation bei Getreiden ist u.a. deshalb so schwierig, weil man diese Pflanzen nur sehr schwer regenerieren kann. „Beim Tabak legen wir ein Stück Blatt auf ein Nährmedium und bekommen dutzende, wenn wir wollen hunderte, neuer Pflanzen. Wenn wir das mit dem gleichen Medium bei Mais machen, passiert gar nichts. Die Gründe dafür kennt kein Mensch.“ Um am Ende nur erfolgreich transformierte Pflanzen zu haben, sind aber mehrfache Selektions- und Regenerationsschritte auf einem antibiotikahaltigen Nährboden nötig. Außerdem ist Getreide gegen das Antibiotikum Spectinomycin, das standardmäßig bei der Plastidentransformation eingesetzt wird, von Natur aus resistent, d. h. eine Unterscheidung zwischen transgenen und transgen-freien Pflanzen ist damit nicht möglich. „Es gibt also eine Reihe technischer Probleme, die bei der Transformation von Getreiden auftreten. Die sollten alle lösbar sein, aber es wird seine Zeit brauchen“, so prophezeit Ralph Bock.
Antibiotikum aus Pflanzen
Nach den möglichen Anwendungen der Plastidentransformation befragt, nennt Ralph Bock drei Forschungsschwerpunkte am Institut in Golm. Das ist zum einen die Produktion von Impfstoffen in Pflanzen, auch von essbaren Impfstoffen. Dabei nutzt man die Fähigkeit der Chloroplasten, sehr viel Eiweiß herzustellen. Eine weitere Arbeitsgruppe versucht den Nährstoffgehalt und damit die Nahrungsmittelqualität von Pflanzen zu erhöhen, insbesondere Pflanzen mit angereichertem Vitamin A oder E-Gehalt sind hier interessant.
In ähnlicher Weise sollen auch neuartige Antibiotika in Pflanzen in großer Menge hergestellt werden. Die Gene, die diese Antibiotika bilden, stammen aus spezifischen Viren. Sie töten den bakteriellen Krankheitserreger durch Auflösen der Zellwand ab. Lysin ist ein solches in transgenen Tabakpflanzen hergestelltes Antibiotikum. Es wirkt sehr effizient gegen den Erreger verschiedener Atemwegs- und Hautkrankheiten (Streptococcus pyogenes). „Innerhalb von Minuten kann man sehen, dass die Zellen sterben“, schwärmt Melanie Oey von dieser Technologie. „Ein weiterer Vorteil ist, dass Lysin hochspezifisch wirkt, man hat nicht das Problem wie bei einem Breitbandantibiotikum, bei dem gleich Mund- und Darmflora auch kaputt gehen. Man testet, welches Bakterium für die Krankheit verantwortlich ist und sucht dann das entsprechende Lysin“.
Bisher wurden Lysine vorwiegend mit Hilfe gentechnisch veränderter Bakterien produziert, jedoch ist die Herstellung in Chloroplasten sehr viel unproblematischer. Denn die Zielstrukturen der Lysine, also die Bestandteile der Bakterienzellwand, kommen im Chloroplasten nicht vor.
Abschließend betont Ralph Bock: „Wir entwickeln keine Produkte. Wir testen aus, was wissenschaftlich machbar ist: Kann man ein Antibiotikum von einer Pflanzen herstellen lassen - ja oder nein?. Tötet das die Krankheitskeime ab - ja oder nein? Alles Weitere ist dann Sache der Industrie.“

