14.01.2010
Forschung Projekte
Gezielter Einbau von Genen bei gleichzeitiger Entfernung des Markergens durch ortsspezifische Rekombinationssysteme
(2005 – 2008) Universität Hamburg, Abteilung für Entwicklungsbiologie und Biotechnologie
Thema
Sobald ein Gen gezielt in eine Pflanze eingebracht wird, ist es von Interesse, dass dieses Transgen stabil in der Pflanze exprimiertwird, insbesondere bei langlebigen Bäumen wie etwa Pappeln. Ansonsten könnten die Pflanzen die hinzugewonnene Eigenschaft im Laufe der Zeit wieder verlieren.
- Deshalb wird angestrebt, das Gen an ganz bestimmte Stellen im Genom zu integrieren – und zwar an solchen, die sich als geeignet für die stabile Integration fremder DNA erwiesen haben.
- Zudem sollen nur solche Gensequenzen übertragen werden, die für das gewünschte Merkmal erforderlich sind. Funktionelle DNA-Sequenzen, die nach erfolgter Transformation nicht mehr benötigt werden, sollen wieder entfernt werden. Dazu zählen etwa Antibiotikarestistenz-Gene.
Es stehen verschiedene Systeme zur Verfügung, um fremde DNA gezielt in ein Pflanzengenom zu integrieren und anschließend das als Marker verwendete Antibiotikaresistenz-Gen zu entfernen. Eines dieser sogenannten ortsspezifischen Rekombinationssysteme ist das FLP/FRT-System. Damit sollen in diesem Forschungsprojekt Pappeln und Weizen transformiert werden.
Informationen zu den Verfahren:
Zusammenfassung
- Das FLP-/FRT-Rekombinationssystem konnte in Weizen und Zitterpappel erstmals erfolgreich angewendet werden, um nicht mehr benötigte Markergene zu entfernen.
- Darüber hinaus wurde mit diesem Rekombinationssystem eine zielgerichtete Integration eines bar-Gens in Zitterpappeln durchgeführt.
- Es steht somit ein praktikables Verfahren zur erfolgreichen Eliminierung eines Markergens mit anschließender zielgerichteter Integration eines Fremdgens für die Herstellung transgener Pflanzen dar.
Versuchsbeschreibung
Wie bereits durchgeführte Untersuchungen zeigten, ist das FLP/FRT-System in Pappeln grundsätzlich anwendbar. In diesem Projekt soll eine praktikable Methode entwickelt werden, um mit Hilfe dieses Systems bei Pappeln und Weizen
- das als Marker verwendete Antibiotikaresistenz-Gen zu entfernen
- dabei durch eine Rekombination das gewünschte Zielgen (gene-of-interest) an eine bestimmte Stelle im Genom zu integrieren.
(1) Herstellung transgener Pappeln und Weizen. Um diese Ziele zu erreichen, werden in einem ersten Schritt verschiedene transgene Weizenpflanzen und Pappeln erzeugt, die ein Antibiotikaresistenz-Gen tragen. Dieses Resistenz-Gen liegt dabei zwischen zwei DNA-Sequenzen. Diese dienen als Markierung, um später das Resistenz-Gen gezielt auszuschneiden und mit dem gewünschten Zielgen auszutauschen (FLP/FRT-System).
(2) Entfernung des Antibiotikaresistenz-Gens. Im zweiten Schritt wurde das Antibiotikaresistenz-Gen durch Rekombination wieder entfernt. Der Vorgang der Rekombination wird hier durch einen Hitzeschock ausgelöst, dem die Pflanze für eine kurze Zeit ausgesetzt wird. Die Aktivierung eines Farbgens (GUS) und anschließende Southern Blot- Analysen zeigen an, ob das Resistenz-Gen tatsächlich entfernt wurde.
(3) Einführung des Zielgens. Nachdem es entfernt wurde, soll im dritten Schritt das Antibiotikaresistenz-Gen gegen das Zielgen (gene-of-interest) ausgetauscht werden. Im Rahmen dieses Projekts wird als Zielgen ein einfach überprüfbares Gen (bar; Resistenz gegen Herbizid-Wirkstoff Glufosinat) verwendet, das eine Herbizidresistenz vermittelt. Auch diese Rekombination wird durch einen Hitzeschock ausgelöst.
Anschließend wurde überprüft, ob die Rekombination zu dem gewünschten Ergebnis geführt hat. Hierfür wurden die Pflanzen mit dem Komplementärherbizid des eingeführten Gens behandelt. Können sie unter diesen Bedingungen wachsen, besitzen sie die durch das Zielgen vermittelte Herbizidresistenz: Die Rekombination war damit erfolgreich.
Analysen des Integrationsortes. Mit Hilfe verschiedener molekularbiologischer Methoden (PCR und Southern-Analysen) werden die Integrationsorte vor und nach der Rekombination bestimmt und analysiert.
Ergebnisse
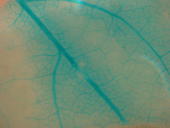
Die Blaufärbung in den Pappelblättern ist der Nachweis für die erfolgreiche Entfernung des Antibiotikaresistenz-Gens. Das Enzym des GUS-Gens kann eine farblose Substanz in einen blauen Farbstoff umsetzen.

Die Kontrolle der Rekombination erfolgte an einem Wildtyp-Pappelblatt: Es zeigt keine Blaufärbung, da das für die Farbreaktion verantwortliche GUS-Gen fehlt.


GUS-gefärbte transgene Weizenblätter. Die Blätter wurden einen Tag nach erfolgter Hitzebehandlung geerntet und mit einem Farbstoff behandelt, Die Blaufärbung ist der Nachweis für die erfolgreiche Entfernung des Antibiotikaresistenz-Gens.
oben: ohne Hitzebehandlung, unten: nach Hitzebehandlung
(1) Herstellung transgener Pappeln und Weizen. Es wurden Genkonstrukte, die das FLP/FRT-System und ein Antibiotikaresistenz-Gen bzw. das Zielgen (bar) tragen, hergestellt. Anschließend wurden Weizenpflanzen (mittels Partikelkanone) und Pappeln (mittels Agrobacterium) mit diesen Konstrukten transformiert. Southern Blot-Analysen zeigten, das mehrere Pappellinien die Konstrukte, die zur Entfernung des Antibiotikaresistenz-Gens bzw. zur Integration des Zielgens benötigt werden, enthalten. Die transgenen Weizenpflanzen enthielten dagegen nur die Genkonstrukte, die zur Entfernung des Antibiotikaresistenz-Gens nötig waren.
(2) Entfernung des Antibiotikaresistenz-Gens. Die anschließende Rekombination, also die Entfernung des Resistenz-Gens, sollte durch einen Hitzeschock ausgelöst werden. Dazu wurden geeignete, auf Hitze reagierende Promotoren verwendet. Untersuchungen im ersten Projektjahr (2006) führten zu einem Promotor, der sowohl in transgenen Pappel- als auch in Weizenpflanzen eingesetzt werden konnte. In Pappeln und Weizen konnte die Entfernung des Antibiotikaresistenz-Gens durch einen Hitzeschock ausgelöst werden. Dies konnte durch Aktivierung des GUS-Farbgens in den Blättern der Pappel- und Weizenlinien nachgewiesen werden. Jedoch war die Farbintensität bei den Weizenlinien wesentlich schwächer als bei der Zitterpappel. Außerdem war eine Mosaikbildung im Färbemuster der Weizenblätter zu erkennen, was zeigte, dass es nur in einzelnen Zellen zu einer erfolgreichen GUS-Gen Aktivierung gekommen war. Die Kontrollen mit transgenen Weizenblättern ohne Hitzebehandlung zeigten keine Färbung.
(3) Einführung des Zielgens. Es konnten keine Weizenlinien hergestellt werden, die das zur Integration benötigte Genkonstrukt enthielten. Daher beschränkten sich die weiteren Arbeiten auf erfolgreich transformierte Pappellinien. Zur Aktivierung des FLP-Rekombinationssystems wurden diese Pflanzen wiederum einem Hitzeschock ausgesetzt. Nach der Hitzebehandlung erfolgte die Selektion auf einem herbizidhaltigen Medium. Dabei konnten sieben von acht untersuchten Pappellinien auf diesem Medium wachsen. Bei ihnen wurde das Gen, dass die Herbizid-Resistenz vermittelt (bar-Gen) an den zuvor definierten Genort erfolgreich eingebaut. Diese Integrationsereignisse wurden zudem durch PCR-Analysen bestätigt.
Thematische Verknüpfungen
Themen
Förderung
Bundesministerium für Bildung und Forschung
Förderkennzeichen
0313264T
Projekt
Originaltitel
Gezielte Integration von Transgenen und Eliminierung von Markergenen mit Hilfe des FLP/FRT-Systems aus Hefe
Kontakt
Dr. Dirk Becker
Universität Hamburg
Abteilung Entwicklungsbiologie und Biotechnologie, AMP II
Ohnhorststr. 18
22609 Hamburg
Tel. 040 / 42816 284/492
Veröffentlichungen
Forschungsprojekte
Optimierung der biologischen Sicherheit transgener Pflanzen 2005-2008
- Markergenelimierung mit dem Ac/Ds-System; Universität Braunschweig
- Erzeugung Markergen-freier Getreidepflanzen durch androgenetische Segregation; IPK Gaterleben
- Erzeugung Markergen-freier Reben durch Nutzung des Cre/lox-Systems; AgroScience, Neustadt
- Erzeugung Markergen-freier Rapspflanzen durch Nutzung des Cre/lox-Systems; Universität Rostock
- Gezielter Einbau von Genen mittels Gene Targeting; Universität Karlsruhe
- Gezielter Einbau von Genen bei gleichzeitiger Entfernung des Markergens durch ortsspezifische Rekombinationssysteme; Universität Hamburg
- Männlich sterile Pflanzen verhindern die Verbreitung von Transgenen; Universität Würzburg
