25.09.2005
Forschung Projekte
Erzeugung Markergen-freier transgener Pflanzen mit Hilfe eines negativen Selektionsmarkers
(2001 – 2004) Universität Rostock, Agrar- und Umweltwissenschaftliche Fakultät, Institut für Landnutzung
Thema
Das für die Transformation von Pflanzenzellen verwendete Markergen (Antibiotikaresistenz-Gen) wurde mit einem negativen Selektionsmarker gekoppelt. Dadurch sollte es möglich werden, in der Nachkommenschaft der transgenen Pflanzen alle Pflanzen, die ein Markergen tragen, zu beseitigen ohne aufwändige Analysen durchführen zu müssen. Pflanzen mit dem Markergen sterben ab und nur markerfreie transgene Pflanzen überleben.
Das Projekt beschäftigte sich im wesentlichen mit zwei Zielen:
- Die unabhängige Integration der beiden Markergene (Antiobiotikaresistenz-Gen und negativer Marker in enger Kopplung) und des Zielgens auf verschiedenen Chromosomen sollte optimiert werden.
- Das Verfahren zur Selektion der Pflanzen, die ein Markergen tragen, sollte verbessert werden. Es soll für verschiedene Pflanzenarten anzuwenden sein.
Informationen zu den Verfahren:
Zusammenfassung
Die Transformationsmethode mit einem Agrobakterienstamm und zwei Plasmiden führte zu hohen Cotransfer-Raten, während die Methode mit zwei Agrobakterienstämmen mit je einem Plasmid niedrigere Raten ergab. Durch Modifikationen des Verfahrens konnte dieser Unterschied ausgeglichen werden.
Es konnte gezeigt werden, dass das Selektionssystem für Pflanzen geeignet ist. Für einen breiten Einsatz ist die Induktor-Substanz jedoch noch nicht rein genug. Zurzeit wird an der Optimierung der Induktor-Substanz gearbeitet, um den Analysenaufwand zur Identifizierung von Pflanzen mit Zielgen um ein Vielfaches zu verringern.
Versuchsbeschreibung
Cotransformation. Zunächst wurden neue Vektoren konstruiert, mit denen Zielgen und Markergene unabhängig voneinander übertragen und getrennt in das Pflanzen-Genom einer Pflanze integriert werden können. Beide Markergene wurden in einer Kassette verkoppelt und auf einem anderen Vektor angeordnet als das Zielgen, welches ein neues Merkmal vermittelt.
Sind Markergene und Zielgen tatsächlich an verschiedenen Stellen im Genom der Pflanze integriert, werden sich diese in deren Nachkommenschaft unterschiedlich auf die einzelnen Pflanzen verteilen. Dies geschieht durch die Neukombination der mütterlichen und der väterlichen Chromosomen bei der Befruchtung der Eizelle. Nur jene Pflanzen, die das Zielgen besitzen, jedoch das Markergen nicht erhalten haben, sollen überleben.
Selektionsmarker. Als negativer Selektionsmarker wurde ein Gen für das Enzym Deacetylase aus E.coli (argE) verwendet. Ist es in einer Pflanze vorhanden, reagiert sie auf eine sonst harmlose Substanz (Induktor) und stirbt ab. Induktor-Substanz war ein Herbizidderivat (= N-Acetyl-Phosphinothricin), das durch das Enzym Deacetylase in ein aktives, für die Pflanze giftiges Herbizid (=Phosphinothricin) umgewandelt wird.
- Das Verfahren wurde für transgenen Raps entwickelt. Dafür gab es bisher noch keine geeignete Induktor-Substanz. Wie schon bei Tabak erfolgreich praktiziert, sollte sie biotechnologisch gewonnen werden.
- Die Selektion wurde im Gewächshaus und später im Freiland getestet und optimiert. Die Pflanzen wurden zusätzlich molekularbiologisch (PCR, Southern-Hybridisierung) untersucht.
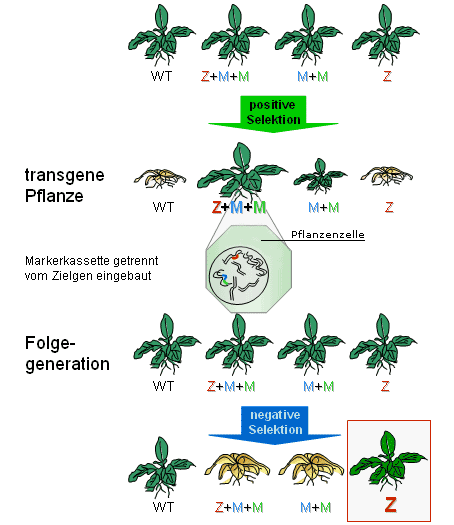
WT=Wildtyp, Z=Zielgen, M=Markergen
Positive Selektion: Pflanzen, die die Markergen-Kassette (mit Antibiotikaresistenz-Gen und negativem Selektionsmarker) enthalten, überleben auf antibiotikahaltigem Nährboden. Negative Selektion: Nachkommen, die die Markergen-Kassette enthalten, sterben ab, weil der negative Selektionsmarker die Umwandlung einer sonst harmlosen Substanz in ein für die Pflanze giftiges Herbizid bewirkt. Markerfreie Pflanzen mit Zielgen überleben.
Ergebnisse
Cotransformation. Als erster Schritt war der getrennte Einbau von Zielgen und den beiden gekoppelten Markergenen erforderlich. Dazu wurde zunächst ein Pflanzentransformations-Vektor entworfen, in dem die beiden Markergene in sehr enger Kopplung vorliegen. Das Zielgen liegt auf einem weiteren Vektor, der dann entweder im gleichen Agrobakterien-Stamm oder in einem zweiten Stamm zur Rapstransformation eingesetzt wird.
Die Cotransformationsraten sind unterschiedlich hoch, je nachdem, ob die beiden Vektoren in einem Bakterienstamm oder in zwei verschiedenen Bakterienstämmen eingesetzt werden.
Wie erwartet führte die Transformationsmethode mit einem Agrobakterienstamm und zwei Plasmiden zu hohen Cotransferraten (Raps 71 Prozent, Tabak 68 Prozent) während die Methode mit zwei Agrobakterienstämmen mit je einem Plasmid bei Raps mit 48 Prozent und bei Tabak mit nur 35 Prozent niedrigere Raten ergab. Durch Modifikationen des Verfahrens konnte dieser Nachteil jedoch ausgeglichen werden (Cotransferrate 47 Prozent), so dass hier sowohl die Cotransferraten als auch die Wahrscheinlichkeit der getrennten Integration hoch genug sind, um markerfreie transgene Nachkommen zu erhalten.
Selektion: Zur Identifizierung dieser Pflanzen wurde als negativer Marker das Deacetylase-Gen aus E.coli (argE) verwendet, dessen Produkt - das Enzym Deacetylase - aus der für Pflanzen ungiftigen Substanz N-Acetyl-Phosphinothricin das Herbizid Phosphinotricin bildet. Es konnte gezeigt werden, dass diese Substanz für die Selektion argE -freier Pflanzen geeignet ist. Der Analysenaufwand zur Identifizierung von Pflanzen mit Zielgen kann dadurch um ein Vielfaches verringert werden. Für einen breiten Einsatz ist die Induktor-Substanz noch nicht rein genug, es sind aber viel versprechende Ansätze zur Aufreinigung vorhanden.
Thematische Verknüpfungen
Themen
Förderung
Bundesministerium für Bildung und Forschung
Förderkennzeichen
0312627 I
Projekt
Originaltitel
Eliminierung von Transformationsmarkern durch die Kopplung mit einem N-Acetyl-Phosphinothricin- Deacetylase-Gen als induzierbarem negativen Selektionsmarker
Kontakt
Universität Rostock,
Agrar- und Umweltwissenschaftliche Fakultät, Institut für Landnutzung,
Justus-von-Liebig-Weg 8,
18051 Rostock
Prof. Dr. Inge Broer
Tel: 0381 498 4080
Fax: 0381 498 4082
Prof. Dr. Peter Leinweber
Tel: 0381 498 2088
Fax: 0381 498 2159
Veröffentlichungen
Forschungsprojekte
Neue Methoden der Gen-Übertragung 2001-2004
- Gezielter Einbau von Genen, Universität Karlsruhe
- Entwicklung alternativer Marker, SunGene
- Ausschneiden unerwünschter Gene bei der Zuckerrübe, Planta
- Ausschneiden unerwünschter Gene: Cre/lox-System, BBA Braunschweig
- Ausschneiden unerwünschter Gene mit Hilfe eines neuen Rekombinationssystems, Bayr. LA Landwirtschaft, Freising
- Negative Marker, Uni Rostock
- Mikroinjektion bei Pflanzen, Uni Giessen
- Gene für die Mikroinjektion, Bioplant
- Geeignete Pflanzenzellen für die Mikroinjektion, Bioplant
- Mikroinjektion, FI Schmallenberg
- Direkte Veränderungen von Pflanzengenen, BBA Braunschweig
- Sicherheitssystem zur Proteinproduktion mittels pflanzlicher Viren, BBA Braunschweig
- Verbesserte binäre Vektoren, BfZ Siebeldingen
- Markergen-freie Pflanzen durch Auskreuzen, MPIZ Köln
- Transformation bei Plastiden, SunGene
