18.11.2002
Forschung Projekte
Untersuchungen zum horizontalen Gentransfer von transgenen Zuckerrüben auf Bakterien
(1994 – 1997) Biologische Bundesanstalt für Land- und Forstwirtschaft (BBA) (seit 2008 Julius Kühn-Institut (JKI)), Institut für Pflanzenvirologie, Mikrobiologie und biologische Sicherheit; Braunschweig
Thema
Kann DNA aus transgenen Pflanzen auf Boden-Mikroorganismen übertragen werden? Um abzuschätzen, ob ein solcher horizontaler Gentransfer möglich ist, spielen nicht nur Aufnahme und Integration der transgenen DNA in Mikroorganismen ein Rolle. Voraussetzung ist auch, dass transgene DNA in einer für die Mikroorganismen verfügbaren Form im Boden vorliegt.
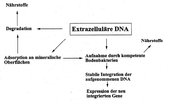
Abb.1: Das Schicksal freier DNA im Boden
Im Wesentlichen wurden folgende Fragen untersucht:
- Wie lange kann transgene Pflanzen-DNA im Boden überdauern?
- Ist horizontaler Gentransfer von transgener Pflanzen-DNA auf Bodenbakterien unter Labor- bzw. Feldbedingungen nachweisbar? Dazu wurde ein bestimmter Bakterienstamm als Modellorganismus eingesetzt.
Zusammenfassung
- DNA von transgenen Zuckerrüben konnte über längere Zeiträume im Boden nachgewiesen werden. Generelle Angaben zum Überdauerungsvermögen transgener DNA im Boden sind jedoch nicht möglich, da dieses von verschiedenen Faktoren abhängt.
- Ein Gentransfer unter natürlichen Bedingungen im Boden konnte nicht nachgewiesen werden.
- Unter idealen Laborbedingungen konnte zum ersten Mal ein horizontaler Gentransfer von transgener Pflanzen-DNA auf natürlich kompetente Bakterien gezeigt werden. Dies funktionierte sogar – allerdings in deutlich geringerem Ausmaß - mit „Pflanzensaft“ (Saft aus homogenisierten Pflanzenzellen, der DNA enthält).
- Trotz dieses Befundes erscheint die Wahrscheinlichkeit eines horizontalen Gentransfers von transgener Pflanzen-DNA auf Bakterien im Boden gering.
Versuchsbeschreibung


Mit einem Bohrstock werden Bodenproben gezogen (oben): 28 Proben pro Parzelle (unten).
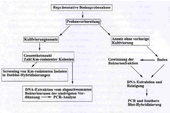
Abb.2: Experimentelles Herangehen für die Untersuchung von Bodenproben vom Freisetzungsstandort
Das Überdauerungsvermögen transgener DNA wurde auf Verrottungsfeldern untersucht: zwei Jahre, 1993 und 1994, wurden nach der Ernte transgene Rübenreste untergepflügt. Danach wurden jeweils im Frühjahr und im Herbst Proben gezogen und nach einem bestimmten Schema untersucht (siehe Abb.2).
Zusätzlich wurde die Überdauerung freier DNA im Boden im Labor untersucht: Bodenproben wurden mit transgener Zuckerrüben-DNA durchmischt und über einen Zeitraum von sechs Monaten mittels PCR beobachtet.
Die Möglichkeit des horizontalen Gentransfers wurde sowohl in der natürlichen Umgebung im Boden als auch unter bestimmten, für einen Gentransfer förderlichen Bedingungen im Labor untersucht.
(1) Als Nachweis für horizontalen Gentransfer im Feld wurde in den Bodenproben nach Bakterien gesucht, die Teile des in die Zuckerrüben eingeführten gentechnischen Konstruktsaufgenommen hatten. Die Nachweise wurden über PCR und Hybridisierungengeführt.
Da nur ein kleiner Teil (0,1-1%) der Bodenbakterien auch unter Laborbedingungen angezüchtet werden kann (kultivierungsabhängige Verfahren), wurde auch DNA untersucht, die direkt aus Bodenproben extrahiert wurde (=kultivierungsunabhängig) und die neben bakterieller DNA aber auch pilzliche, pflanzliche sowie freie DNA enthält. Diese DNA wurde mittels PCR unter Verwendung von Primern, die für das gentechnische Konstrukt spezifisch sind, auf das Vorhandensein transgener DNA analysiert. Diese Primer erlauben einen spezifischen und sensitiven Nachweis der transgenen DNA.
(2) Für einen horizontalen Gentransfer unter optimierten Laborbedingungen wurden zwei Versuchsansätze gewählt. Als Modellorganismus diente das Bakterium Acinetobacter.
Zuerst wurde mit verschiedenen DNA (von Bakterien, Plasmid-DNA, transgene Pflanzen-DNA) die Aufnahmefähigkeit von Bakterienzellen untersucht.
Ein horizontaler Gentransfer ist ein sehr seltenes und daher nur schwer nachweisbares Ereignis. Es wurde daher ein besonderer Acinetobacter-Stamm entwickelt mit idealen Voraussetzungen für einen Gentransfer: In die Bakterien wurde ein unvollständiges nptII-Gen (Kanamycin-Resistenz) eingeführt. Das komplette Gen ist in den Zuckerrüben als Markergen vorhanden. Über bestimmte Mechanismen (homologe Rekombination) kann der spezielle Acinetobacter-Stamm sein nptII-Gen vergleichsweise einfach über die Aufnahme transgener Pflanzen-DNA vervollständigen.
Bei beiden Versuchsansätzen wurde sowohl die Zahl der Transformanten als auch die Transformationshäufigkeit ermittelt.
Ergebnisse
Überdauerungsvermögen transgener DNA im Boden
- Im Verrottungsfeld 1993 konnte die transgene Zuckerrüben-DNA in der direkt aus den Bodenproben extrahierten Gesamt-DNA (kultivierungsunabhängige Analyse) über zwei Jahre nachgewiesen werden.
- Im Verrottungsfeld 1994 konnten dagegen bereits nach sechs Monaten nur noch geringe Mengen an transgener DNA gefunden werden. Es lässt sich jedoch nicht eindeutig sagen, ob die nachgewiesene transgene DNA als freie DNA vorliegt oder in verrottenden Pflanzenresten „verpackt“.
- Im Laborversuch (kultivierungsabhängige Analyse) konnte die transgene DNA je nach verwendeter PCR-Methode noch nach einem, drei bzw. sechs Monaten nachgewiesen werden.
Horizontaler Gentransfer
(1) Freilandbedingungen (kultivierungsabhängige Analyse)
- In beiden Verrottungsfeldern stieg die Zahl der Bakterien nach dem Eintrag des zerschredderten Rübenmaterials infolge des Nährstoffeintrags vorübergehend an. Etwa 4500 Bakterien, die eine Resistenz gegen Kanamycin aufwiesen, wurden näher untersucht. In keinem Fall waren transgene DNA-Sequenzen nachweisbar. Die Resistenzeigenschaft der Bakterien beruhte nicht auf dem in den Zuckerrüben vorhandene nptII-Gen. (siehe: Tabelle 1)
(2) Laborbedingungen
- Auch unter Laborbedingungen wurden keine Transformanten entdeckt, die transgene Pflanzen-DNA aufgenommen Es gab damit keine Anzeichen, die auf einen horizontalen Gentransfer hindeuten könnten.
(3) Optimierte Laborbedingungen
- Unter optimierten Laborbedingungen konnte beobachtet werden, dass der „präparierte“, mit einem unvollständigen nptII-Gen versehene Acinetobacter-Stamm vereinzelt transgene Zuckerrüben-DNA aufgenommen hat. Transformationen mit nicht-transgener Zuckerrüben-DNA wurde nicht gefunden. (siehe: Tabelle 2)
- Der Gentransfer der transgenen DNA konnte auf eine Homologie (Ähnlichkeit von DNA-Sequenzen) zwischen der DNA des Acinetobacter-Stamm und der transgenen DNA zurückgeführt werden.
Ein Gentransfer von transgenen Pflanzen auf Acinetobacter sp. BD413 konnte bei Vorhandensein homologer Sequenzen und nur unter optimierten Bedingungen nachgewiesen werden.
|
Tabelle 1: Häufigkeit eines horizontalen Gentransfers unter natürlichen Bedingungen im Boden (aus: Nielsen et al, 1997) (natürlich vorkommende Acinetobacter-Bakterien) |
| eingesetztes DNA- Material | Erhaltene Transformanten (Anzahl Mikroorganismen, die DNA aufgenommen haben, bezogen auf die Mengeneinheit der verabreichten DNA) | durchschnittliche Transformationsfrequenz (Häufigkeit eines Gentransfer bezogen auf Gesamtzahl Mikroorganismen) | ||
| Plasmid*-DNA (ringförmig) | 27000
|
1,9 x 10-5 1 Transfer auf 190.000 | ||
| Plasmid-DNA (linear; aufgetrennte Ringstruktur) | 100 | 2,0 x 10-8 1 Transfer auf 200 Millionen | ||
| transgene DNA aus Zuckerrüben | nicht nachweisbar | -11 kleiner als 1: 100 Milliarden | ||
| * Plasmide sind ringförmige DNA-Elemente, die zwischen Bakterien häufig ausgetauscht werden. | ||||
|
Tabelle 2: Häufigkeit eines horizontalen Gentransfers unter optimalen Laborbedingungen (aus: Gebhard und Smalla, 1998) |
| eingesetztes DNA- Material | Erhaltende Transformanten (Anzahl Mikroorganismen, die DNA aufgenommen haben, bezogen auf die Mengeneinheit der verabreichten DNA) | durchschnittliche Transformationsfrequenz (Häufigkeit eines Gentransfer bezogen auf Gesamtzahl Mikroorganismen) |
| Plasmid-DNA | 110000 | 9,85 x 10-5 1 Transfer auf 985.000 |
| transgene DNA aus Zuckerrüben | 33 | 5,36 x 10-9 1 Transfer auf 5,36 Milliarden |
| nicht-transgene DNA aus Zuckerrüben | 0 | 0 |
| Pflanzensaft aus transgenen Zuckerrüben (homogenisierte Pflanzenzellen) | 1,5 | 1,5 x 10-10 1 Transfer auf 24 Milliarde |
Thematische Verknüpfungen
Themen
Querschnittsthemen
Förderung
Bundesministerium für Bildung und Forschung
Förderkennzeichen
0310642
Projekt
Originaltitel
Untersuchungen zum horizontalen Gentransfer von transgenen Zuckerrüben auf zuckerrübenassoziierte Bakterien und Bodenbakterien
Kontakt
PD Dr. Kornelia Smalla
Biologische Bundesanstalt für Land- und Forstwirtschaft (BBA)
(seit 2008 Julius Kühn-Institut (JKI)),
Institut für Pflanzenvirologie, Mikrobiologie und biologische Sicherheit
Messeweg 11/12
38104 Braunschweig
Veröffentlichungen
Publikation der Ergebnisse:
Nielsen, K.M., Gebhard, F., Smalla, K., Bones, A.M., van Elsas, J.D. (1997) Evaluation of possible horizontal gene transfer from transgenic plants to the soil bacterium Acinetobacter calcoaceticus BD413. Theor. Appl. Genet. 95, 815-821
Gebhard, F., Smalla, K. (1998) Transformation of Acinetobacter sp. BD413 by transgenic sugar beet DNA. Appl. Environ. Microbiol. 64 1550-1554
Gebhard, F., Smalla, K. (1999) Monitoring field releases of genetically modified sugar beets for persistence of transgenic plant DNA and horizontal gene transfer. FEMS Microbiol. Ecol. 28, 261-272
Nielsen, K.M., van Elsas, J.D., Smalla, K. (2000) Transformation of Acinetobacter sp. Strain BD413 (pFG4ΔnptII) with Transgenic Plant DNA in Soil Microcosms and Effects of Kanamycin on Selection of Transformants. Appl. Environm. Microbiol. 66, 1237-1242
Smalla, K., Gebhard, F., Heuer, H. (2000) Antibiotika-Resistenzgene als Marker in gentechnisch veränderten Pflanzen Gefahr durch horizontalen Gentransfer? Nachrichtenbl. Deut. Pflanzenschutzd. 52, 62-68
Projektbericht in: Proceedings zum BMBF-Workshop, Braunschweig, 1998, S.121ff
Forschungsprojekte
Virusresistente Zuckerrüben
- Ökologische Untersuchungen zur Einschätzung der Umweltrisiken von transgenen virusresistenten Zuckerrüben, RWTH Aachen, Biologie V Themenschwerpunkt (1): Umweltverhalten transgener Zuckerrüben
- Themenschwerpunkt (2): Umweltverhalten verschiedener Kreuzungshybriden von Kultur- und Wildrüben bzw. Mangold
- Themenschwerpunkt (3): Analyse des Genflusses zwischen Kultur-, Wild- und Unkrautrüben.
- Monitoring von transgenen Eigenschaften (Herbizid-, Virus-, Nematoden- und Pilzresistenz) in Unkraut- und Wildrüben, RWTH Aachen, Biologie V
- Untersuchungen zur Genexpression in transgenen Zuckerrüben/Mangold- Hybriden, BBA Braunschweig
- Erstellung eines Modells zu Gentransfer und Verwilderung bei transgenen Zuckerrüben, Uni Gießen
- Untersuchung des Einflusses von transgenen virusresistenten Zuckerrüben auf andere Viren, BBA Braunschweig, IfZ Göttingen
- Untersuchungen zum horizontalen Gentransfer von transgenen Zuckerrüben auf Bakterien, BBA Braunschweig Austritt von DNA aus transgenen Zuckerrüben und horizontaler Gentransfer im Boden, Uni Oldenburg
