Bakterien als „CO2-Fresser“
Forscher zwingen E. coli zur Umstellung auf eine autotrophe Lebensweise
Escherichia coli-Bakterien. (Bildquelle: © iStock.com/cgtoolbox)
Wissenschaftlern ist es gelungen, den Stoffwechsel des Bakteriums Escherichia coli so zu verändern, dass es sich ausschließlich von Kohlendioxid ernährt. Ihre Vision ist es, so eines Tages alle organischen Verbindungen aus Kohlendioxid und erneuerbaren Energien herstellen zu können.
Die Welt lässt sich ganz grob in zwei Arten von Lebewesen teilen. Da wären einerseits die autotrophen Organismen, die Kohlendioxid in Biomasse umwandeln. Alle Pflanzen zählen in diese Kategorie, einige Bakterien ebenso. Auf der anderen Seite gibt es die heterotrophen Organismen, die eben diese Biomasse wieder zu Kohlendioxid abbauen. Einem internationalen Team von Wissenschaftlern ist es nun gelungen, das eigentlich heterotrophe Bakterium Escherichia coli in einen autotrophen Organismus zu verwandeln. Es kann sich ausschließlich von Kohlendioxid als Kohlenstoffquelle ernähren und daraus organische Verbindungen herstellen.
Ein rein rationaler Ansatz? Zu kompliziert!
„Manche Probleme sind zu kompliziert als dass man sie alleine mit einem rationalen Ansatz lösen könnte“, sagt Arren Bar-Even, einer der Autoren der Studie und Gruppenleiter am Max-Planck-Institut für Molekulare Pflanzenphysiologie in Potsdam. Die Umstellung des Stoffwechsels von heterotropher auf autotrophe Lebensweise ist ein solches Problem. „Es ist schwer vorherzusagen, welche genetischen Veränderungen dafür notwendig sind“, erklärt er, „doch die Evolution findet eine Lösung.“ Genau diesen Ansatz verfolgten die Wissenschaftler: Unter selektiven Bedingungen sollten sich die Bakterien durch zufällige Mutationen zu vollständig autotrophen Organismen entwickeln.

Es gibt autotrophe und heterotrophe Organismen. Pflanzen zählen zu den autotrophen Organismen und wandeln Kohlendioxid in Biomasse um.
Bildquelle: © Pixabay/CC0
Evolutionäre Geburtshilfe
Um der Evolution zusätzlich auf die Sprünge zu helfen, erdachten sich die Forscher eine clevere Strategie. Das Bakterium sollte bei der Kohlenstofffixierung fortan von einem einzigen Energiespender abhängig sein, der auch durch elektrischen Strom produziert werden kann: Ameisensäure. So könnte zukünftig Kohlendioxid durch erneuerbare Energien aus Windkraft- oder Photovoltaikanlagen in den Bakterien in Biomasse umgewandelt werden.
Die Bakterien erhielten dazu durch Genübertragungen zunächst die Enzymmaschinerie geliefert, mit der sie Kohlendioxid in ihren Stoffwechsel einspeisen und mit Hilfe der Ameisensäure zu organischen Verbindungen reduzieren können: die pflanzliche RuBisCO, die Phosphoribulokinase, alpha-Carboanhydrase und Formiatdehydrogenase.
Zusätzlich schalteten die Wissenschaftler Gene aus, die für zwei zentrale Enzyme des bisher üblichen Kohlenstoff-Stoffwechsels im Bakterium kodieren: die Phosphofructokinase in der Glykolyse und die Glucose-6-phosphat-Dehydrogenase im oxidativen Pentose-Phosphat-Weg. Wenn diesen Bakterien neben Kohlendioxid nur noch der C5-Zucker Xylose im Nährmedium zur Verfügung steht, ist das Zellwachstum abhängig von einer Carboxylierung der Xylose durch RuBisCO im sogenannten Calvin-Benson-Bassham-Zyklus.
Die so genetisch umgestalteten Bakterien benötigen trotz der Möglichkeit zur CO2-Fixierung jetzt immer noch den Zucker Xylose für den Aufbau von organischen Substanzen – sie sind also noch heterotroph.
Selektionsdruck für den Weg in die Autotrophie
Für die nun folgenden Schritte setzte das Forscherteam auf die Kraft der Evolution. Damit diese in die richtige Richtung geht, muss ein geeigneter Selektionsdruck auf die Organismen ausgeübt werden: Die Wissenschaftler gaben die E. coli-Bakterien in einen Chemostat. In einem solchen Kulturgefäß wird kontinuierlich Nährmedium zugeführt und verbrauchtes Nährmedium abgeführt. Das Nährmedium enthielt neben den Energielieferant Ameisensäure nur begrenzte Mengen des Zuckers Xylose, sodass die Bakterien auch nur limitiert Kohlendioxid fixieren konnten. In der Luft befand sich eine erhöhte Menge Kohlendioxid (zehn Prozent). Die Kombination aus wenig Zucker und viel Kohlendioxid diente als evolutionärer Anreiz dafür, den Stoffwechsel in die richtige Richtung zu verschieben.
Die Evolution erzeugt die gewünschten Mutationen
„Sobald ein Bakterium durch Mutation in seinem Erbgut die Fähigkeit erlangt, Kohlendioxid ohne Xylose als Nahrung zu verwenden, hat es sofort einen enormen Vorteil und kann sich viel schneller teilen als alle anderen Bakterien in der Lösung“, erklärt Bar-Even. Dadurch wird über kurze Zeit die gesamte Bakterienpopulation ausgetauscht.
Jede Woche entnahmen die Wissenschaftler Bakterien aus dem Chemostat und testeten, ob sich ihr Stoffwechsel bereits auf autotrophe Ernährung umgestellt hatte. Nach etwa 200 Tagen, das sind rund 150 Generationen, fanden sie tatsächlich autotrophe E. coli. Sie ließen das Experiment aber noch bis zum 350. Tag laufen, bevor sie Xylose komplett aus dem Nährmedium entfernten.
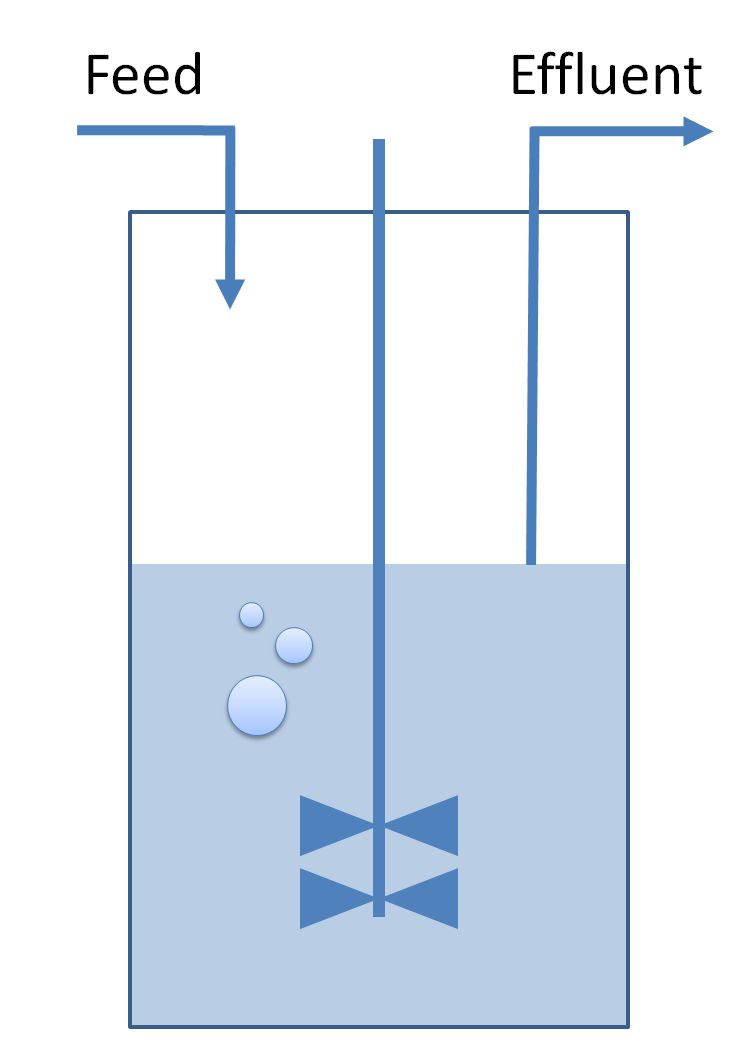
Einfaches Schema eines Chemostats mit Zulauf (feed) und Ablauf (effluent).
Bildquelle: © Rintze Zelle / wikimedia.org / public domain
Sechs veränderte Gene bewirken kompletten Umbau des Metabolismus
Sechs der besonders robust wachsenden Bakterienklone unterzogen die Wissenschaftler genaueren genetischen Analysen. Sie wollten wissen, welche Gene denn nun wirklich nötig gewesen waren, um den gesamten Stoffwechsel umzukrempeln. Das erstaunliche Ergebnis: viel weniger als gedacht. In allen sechs Klonen waren gerade einmal sechs Gene verändert beziehungsweise ausgeschaltet. Zwar traten darüber hinaus in einzelnen Klonen noch mehr Mutationen auf, diese scheinen aber keine Rolle für den neuen Stoffwechsel zu spielen.
Bei den mutierten Genen handelt es sich beispielsweise um solche für Enzyme des Calvin-Zyklus, z. B. die Ribosephosphate-Diphosphokinase und die Glucosephosphat-Isomerase. Die Wissenschaftler nehmen an, dass durch Stilllegung der Gene oder Veränderung der enzymatischen Aktivitäten es zu einer kinetischen Stabilisierung des Calvin-Zyklus an seinen wichtigen Abzweigungsstellen kommt.
„Diese Ergebnisse sind überraschend und ermutigend zugleich“, sagt Bar-Even. „Sie zeigen uns, wie flexibel lebende Organismen sind.“ Er betont außerdem: Es wäre extrem schwierig gewesen, diese Veränderungen vorherzusagen.
Weg von der erdölbasierten Wirtschaft
Diese Forschung hat zwei Ziele. Zum einen wäre da der rein wissenschaftliche Erkenntnisgewinn: Wie dick ist die Trennlinie zwischen autotropher und heterotropher Ernährungsweise? Da weiß man jetzt schon: Nicht ganz so dick wie einst gedacht. Und zum anderen soll natürlich auch die Gesellschaft etwas von der Forschung haben, wenn auch vielleicht erst in ein paar Jahren. Wenn es gelänge, Bakterien wie E.coli zu effizienten autotrophen Bakterien umzuwandeln, dann könnte man sich vielleicht bald vom Zeitalter der fossilen Energien verabschieden.
Denn noch nutzen wir hauptsächlich Erdöl, um daraus Treibstoff, Plastik oder Kosmetika herzustellen. Wenig nachhaltig und schlecht für das Klima. In Zukunft könnten wir die Energie aus erneuerbaren Energien wie Sonne, Wind oder Wasser dafür nutzen, alle diese Stoffe in autotrophen Bakterien herzustellen. „E. coli lässt sich sehr einfach genetisch verändern, um dann genau das zu produzieren, was wir brauchen“, sagt Bar-Even. Eine erste Anwendungsmöglichkeit sieht er in der Produktion einzelner Plastikmoleküle. Auch Lösungsmittel für die Industrie oder pharmazeutische Produkte könnten gut in E. coli hergestellt werden.
Es wäre sogar möglich, Mikroben als Nahrungs- und Futtermittel zu verwenden. Die Ernährung der Menschheit ließe sich dann theoretisch komplett von der Landwirtschaft entkoppeln. Das ist bisher zwar noch eine Vision, aber keineswegs eine abwegige.
Quelle:
Gleizer, S. et al. (2019): Conversion of Eschericia coli to Generate All Biomass Carbon from CO2. In: Cell, (27. November 2019), doi: 10.1016/j.cell.2019.11.009.
Zum Weiterlesen:
- AIDS-Impfstoff aus Algen - Chlamydomonas reinhardtii auf dem Weg zum Pharma-Star
- Aus CO2 wird „grünes Öl“ - Kohlenstoffgewinnung aus Kohlendioxid schont fossile Quellen
- Was kommt nach dem Erdöl? - Künstliche Photosynthese als Energiequelle
Titelbild: Escherichia coli-Bakterien. (Bildquelle: © iStock.com/cgtoolbox)
