CRISPR/Cas macht Pflanzenviren resistent
Pflanzenschutz mithilfe von CRISPR/Cas birgt Risiken

Vom Mosaikvirus befallene (links) und gesunde (rechts) Maniokpflanzen. (Bildequelle: © Hervé Vanderschuren)
Mit der Genschere CRISPR/Cas lassen sich gefährliche Pflanzenviren zerschneiden und unschädlich machen. Es gibt daher Überlegungen, dieses Potenzial für den Pflanzenschutz zu nutzen. Nun zeigt eine Studie aber, dass dabei resistente Viren entstehen können.
Gemini-Viren befallen eine Reihe wichtiger Nutzpflanzen und verursachen erhebliche Ernteschäden. Bei Maniok, einem wichtigen Grundnahrungsmittel für mehr als eine Milliarde Menschen in Südamerika, Afrika und Asien, geht auf diese Weise jährlich ein Fünftel der Ernte verloren. Doch der Pflanzenschutz tut sich schwer damit, wirkungsvolle Gegenmaßnahmen zu entwickeln. Hoffnung ruht auf den neuen Möglichkeiten der Genom-Editierung. Doch diese Hoffnung hat nun einen Dämpfer erhalten.
Pflanzen mit CRISPR/Cas9 ausstatten
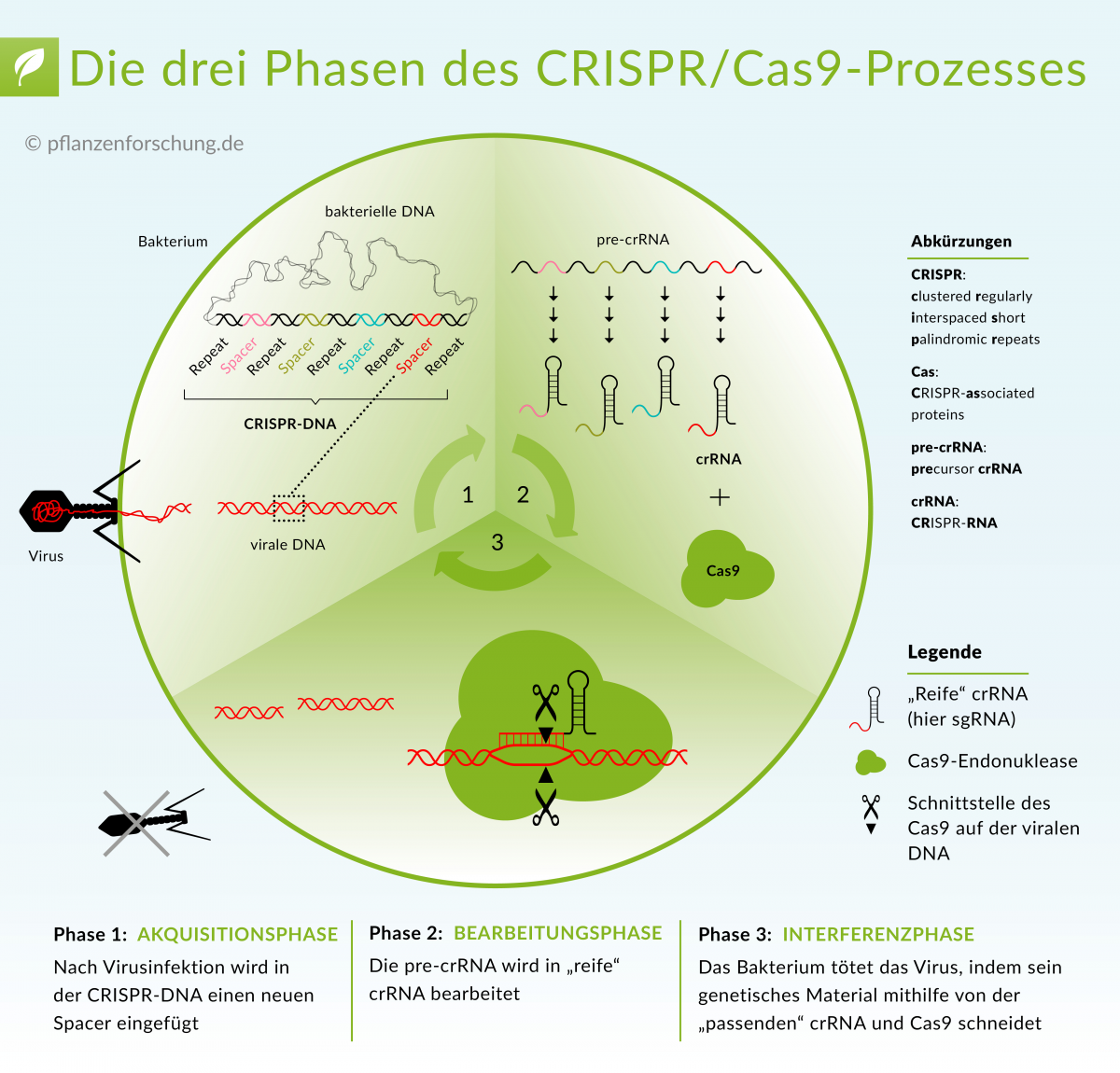
CRISPR/Cas-Systeme von Prokaryoten sind aus CRISPR-DNA und Cas-Proteinen zusammengesetzt und bilden eine adaptive Immunantwort gegen Viren.
Bildquelle: © Pflanzenforschung.de
Ein wichtiges Werkzeug der Genom-Editierung ist CRISPR/Cas9, mit dem sich Bakterien und Archaeen gegen Viren verteidigen. Molekularbiologen nutzen dieses System hauptsächlich, um Gene gezielt zu verändern. Denkbar ist aber auch, CRISPR/Cas in das Erbgut von Pflanzen zu integrieren, damit sich diese ähnlich wie die Mikroorganismen gegen eindringende Viren wehren können. Erste derartige Versuche hat es bereits gegeben.
Forscher haben nun das CRISPR/Cas9-System in Maniok-Pflanzen integriert, um diese gegen das Afrikanische Maniok-Mosaikvirus (ACMV) resistent zu machen, das zu den Gemini-Viren gehört. Doch wider Erwarten zeigte keine der transformierten Linien eine höhere Widerstandsfähigkeit gegen das Virus als die beiden nichttransformierten Kontrolllinien.
5.000 Virusgenome sequenziert
Um zu verstehen, was geschehen war, untersuchten die Forscher das Genom der Mosaikviren. Je Pflanze sequenzierten sie die Genome von mindestens 100 Viren, jeweils drei und acht Wochen nach der Infektion, insgesamt gut 5.000 Genome.
Bei einigen Maniok-Linien fanden die Biologen bei den Viren die erwarteten Spuren der CRISPR/Cas9-Aktivität. Die Analyse der Proteine der Zielgene ac2 und ac3 zeigte, dass die Genschere die beiden Gene wie gewünscht zerschnitten hatte.
Konservierte Punktmutation verleiht Resistenz
Allerdings ergaben die Genomanalysen auch, dass eine bestimmte Genomveränderung bei den Viren der transformierten Pflanzen sehr verbreitet war: In einem Abschnitt des ac2-Gens war bei drei Linien an einer bestimmten Stelle ein Nukleotid, mit der Nukleobase Thymin, eingefügt worden. Jedes zweite bis dritte Virus in diesen Linien war betroffen, aber keines in den Kontrollpflanzen. Die Häufigkeit des Vorkommens deutete darauf hin, dass die konservierte Mutation den Viren einen Selektionsvorteil darstellte.
Tatsächlich befand sich die Insertion genau an der Stelle, an der die Genschere ansetzen sollte. Doch das konnte sie nun infolge der Mutation nicht mehr. Viren mit der Thymin-Insertion waren immun geworden gegen den CRISPR/Cas9-Mechanismus, den die Forscher den Maniokpflanzen eingesetzt hatten.
Übersicht: Nukleobasen, auch Nukleinbasen
| Base: | Bestandteil von: |
| Adenin (A) | DNA und RNA |
| Cytosin (C) | DNA und RNA |
| Guanin (G) | DNA und RNA |
| Thymin (T) | nur DNA |
| Uracil (U) | nur RNA |
Technik begünstigt eigenes Versagen
„Unsere Schlussfolgerung ist, dass diese Technologie Selektionsdruck auf die Viren erzeugt, schneller zu mutieren, und ihnen gleichzeitig die Mittel dazu gibt. Das resultiert in einer Virusmutante, die gegen unsere Intervention resistent ist“, erläutert Erstautor Devang Mehta. Hinzu kommen die DNA-Reparaturmechanismen, die in Eukaryoten – anders als in Bakterien und Archaeen – manchen Eingriff des CRISPR/Cas9-Systems rückgängig machen.
Im konkreten Fall führte die Mutation zwar auch dazu, dass sich die resistenten Viren nur vermehren konnten, wenn gleichzeitig Wildtyp-Viren anwesend waren. Doch die Beobachtung zeigt ein grundsätzliches Risiko auf, wenn CRISPR/Cas9 genutzt werden soll, um Pflanzen Immunität gegen Viren zu verleihen. Die beteiligten Forscher raten daher dringend zu weiteren Studien, bevor entsprechende Pflanzen in Feldversuchen getestet werden.
Zudem weisen sie darauf hin, dass es bislang zwar in der EU, in Japan und in den USA regulatorische Bestimmungen für Pflanzen gebe, die mit CRISPR/Cas9 editiert wurden. Für Pflanzen, die so verändert wurden, dass sie konstitutiv Cas9 exprimieren, fehle die Regulation jedoch. Eine Voraussetzung darin sollte sein, dass die Viruspopulationen während der entsprechenden Studien umfassend sequenziert werden.
Suche nach Verbesserungen
Die Methode als solche wollen die Forscher nicht verwerfen. Künftige Studien sollen deshalb zeigen, ob effizientere Cas9-Versionen schneller arbeiten können als die Viren ihre Resistenz entwickeln und ob der Einsatz sogenannter gepaarter Nickasen oder die Deletion größerer Abschnitte des Virusgenoms der Resistenzbildung vorbeugen können.
Quelle:
Mehta, D. et al. (2019): Linking CRISPR-Cas9 interference in cassava to the evolution of editing-resistant geminiviruses. In: Genome Biology (2019) 20:80, doi: 10.1186/s13059-019-1678-3.
Zum Weiterlesen auf Pflanzenforschung.de:
- Was ist Genom-Editierung?
- Ein Baukasten für Biologen zur Genom Editierung - Ein neues Werkzeug für die gezielte Veränderung von Genen mit Cas9
- Effiziente neue Genschere - Die Genschere CRISPR/Cpf1 arbeitet präziser als das bisherige Standardwerkzeug CRISPR/Cas9
- Gibt es neben Chancen auch Risiken von CRISPR/Cas9?
Titelbild: Vom Mosaikvirus befallene (links) und gesunde (rechts) Maniokpflanzen. (Bildequelle: © Hervé Vanderschuren)
