Das eine quetscht, das andere zieht
Rotalgen haben Helferprotein zur effizienteren Photosynthese (Quelle: © iStockphoto.com/Nancy Nehring)
Ohne Photosynthese wäre das heutige Leben auf der Erde nicht möglich. In Pflanzen ist dieser Prozess jedoch weniger effizient als in Rotalgen. Max-Planck-Forscher entdeckten ein Photosynthese-Helferprotein in Rotalgen, das für deren produktiveren Arbeitsstil verantwortlich ist.
Da es ohne Photosynthese wohl keinen freien Sauerstoff auf der Erde gäbe, gehört dieser Prozess zu den wichtigsten Stoffwechselleitungen überhaupt. Pflanzen, Algen und Plankton sind in der Lage, Kohlenstoffdioxid (CO2) und Wasser in Sauerstoff und Zucker umzuwandeln. Das Enzym Ribulose-1,5-bisphosphat-carboxylase/-oxygenase (kurz: RuBisCo) ist vermutlich das mengenmäßig häufigste, wasserlösliche Protein der Erde. Es bindet CO2 und leitet die Umwandlung in Zucker und Sauerstoff ein.
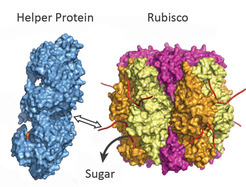
Das Helferprotein (blau) zieht an einem Ende von Rubisco (bunt) und setzt so den Zucker frei. Die Blockade ist aufgehoben. (Quelle: © Manajit Hayer-Hartl / Max-Planck-Institut für Biochemie)
In Rotalgen läuft die Photosynthese effizienter ab als in Pflanzen, obwohl sie nur einen geringfügig veränderten Mechanismus nutzen. Forscher vom Max-Planck-Institut für Biochemie (MPIB) in Martinsried bei München haben jetzt ein bisher unbekanntes Helferprotein der Photosynthese in Rotalgen entdeckt, das für die produktivere Umwandlung verantwortlich ist. „Wir konnten seine Struktur und seinen faszinierenden Mechanismus entschlüsseln“, erläutert Manajit Hayer-Hartl, Leiterin der Forschungsgruppe „Chaperonin-vermittelte Proteinfaltung“ am MPIB.
Trotz seiner großen Bedeutung für das heutige Leben auf der Erde, arbeitet Rubisco nicht fehlerfrei. Manchmal bindet das Enzym falsche Zuckermoleküle, die dann seine Aktivität hemmen. Damit Rubisco in einem solchen Fall weiterarbeiten kann, benötigt es die Hilfe eines speziellen Proteins, einer Rubisco-Aktivase. Dieses Protein entfernt die störenden Zuckermoleküle. Dass dieser Prozess in Pflanzen und Rotalgen auf unterschiedliche Art und Weise von statten geht, entdeckten nun die Forscher vom MPIB.
Im Laufe der Evolution haben sich zwei verschiedene Rubisco-Aktivasen in Pflanzen und Rotalgen entwickelt. Sie unterscheiden sich in ihrem dreidimensionalen Aufbau und in ihren Arbeitsmechanismen. Die neu entdeckte Rubisco-Aktivase in Rotalgen repariert blockierte Rubisco-Proteine, in dem sie an einem Ende des Proteins zieht - wie jemand, der an einem Schnürsenkel zieht. Dadurch öffnet das Helferprotein das aktive Zentrum von Rubisco und setzt so den Zucker frei. Die entsprechende Rubisco-Aktivase in Grünpflanzen funktioniert dagegen eher wie ein Eieröffner: Sie quetscht das inaktive Rubisco-Protein und zwingt es so, die Zuckermoleküle frei zu lassen. „Das Verständnis der Struktur und Funktion der beiden Helferproteine könnte helfen Pflanzen und Mikroorganismen herzustellen, die effektiver arbeiten und somit mehr CO2 in Biomasse umwandeln“, hofft Manajit Hayer-Hartl.
Quellen:
- Mueller-Cajar O, et al., Structure and function of the AAA( ) protein CbbX, a red-type Rubisco activase. In: Nature. 2011 Nov 2. doi: 10.1038/nature10568.
- Stotz M, et al., Structure of green-type Rubisco activase from tobacco.
Nat Struct Mol Biol. 2011 Nov 6. doi: 10.1038/nsmb.2171.
Anregungen zum Weiterlesen:
Wie Pflanzen schlechten Lichtbedingungen trotzen
