Friedliche Invasion im Tarnumhang
Pilze tarnen ihre Zellwandstruktur, um Pflanzenabwehr zu umgehen

Gerste ist eine bekannte Wirtspflanze des Pilzes Piriformospora indica, mit dem sie eine Symbiose eingeht. (Bildquelle: © Johannes D./wikimedia.org; CC BY SA 3.0)
Forscher entdecken ein Protein, mit dem ein Pilz bei der Besiedlung einer Pflanze für ihn typische β-Glucane in der Zellwand maskieren kann.
Pathogene verfügen über allerlei Techniken, um sich in einer Pflanze einzunisten. Ebenso haben Pflanzen diverse Abwehrmechanismen entwickelt, um den Pilz zu stoppen. Allerdings ist nicht jeder Eindringling gleich ein Feind: Manche Pilze sind Symbionten, also potentielle „Freunde“ der Pflanze. Aber auch sie müssen die Pflanzenabwehr mithilfe von Tricks umgehen. In einer neuen Studie des Botanischen Institutes der Universität Köln, des Institutes der Organischen Chemie der Universität Würzburg und des Max-Planck-Institutes für Terrestrische Mikrobiologie in Marburg befassten sich Forscher mit einem neu entdeckten Protein, das einem symbiontischen Pilz hilft, seine Besiedlung der Pflanze zu tarnen.
Pflanze-Pilz-Interaktion
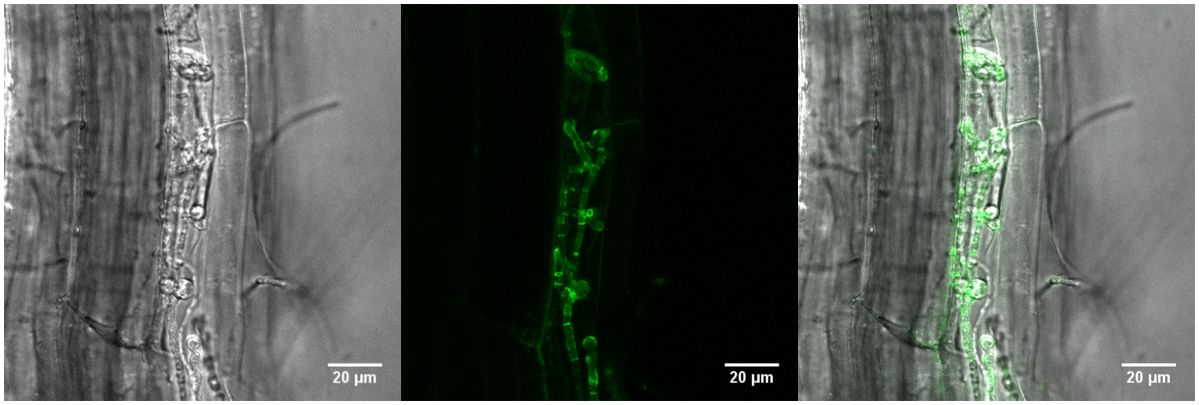
Die Bilder zeigen eine Pflanzenwurzel, die vom Pilz Piriformospora indica besiedelt ist. Die grüne Färbung deckt auf, an welchen Stellen sich das Protein FBG1 befindet.
Bildquelle: © Stephan Wawra
Pflanzen haben eine Vielzahl von Verteidigungsmechanismen, mit denen sie Eindringlinge „willkommen heißen“. Einer davon ist der Oxidative Burst (engl. „burst“ = Ausbruch). Er bezeichnet eine sehr schnelle Reaktion der Pflanzenzelle auf das Eindringen von außen. Durch den Oxidativen Burst werden reaktive Sauerstoffspezies (reactive oxygen species, ROS) freigesetzt, wie zum Beispiel Wasserstoffperoxid (H2O2). Durch das schlagartige Freisetzen der ROS kann die Pflanze eine Besiedelung durch einen Pathogen oftmals verhindern. Zudem bewirkt die Freisetzung, dass im pflanzeneigenen Immunsystem weitere Abwehrreaktionen anlaufen und die Besiedlung endgültig stoppen.
Typische Erkennungszeichen
Wodurch wird der Oxidative Burst ausgelöst? Pflanzen können bestimmte Moleküle, die für Pilze oder andere Mikroorganismen typisch sind, erkennen. Diese Komponenten werden als MAMPS bezeichnet (Microbe-Associated Molecular Patterns). Zu diesen MAMPS gehört zum Beispiel das Molekül Chitin, ein notwendiger Baustein der Zellwände von Pilzen. Da die Zellwand des Pilzes das erste ist, das mit der Pflanze in Kontakt kommt, kann die Pflanze Chitinmoleküle besonders gut erkennen und startet sofort ihr Abwehrsystem. Um zu verhindern, dass die Pflanze aktiv wird, versucht der Pilz im Gegenzug, sein Eindringen zu vertuschen, zum Beispiel durch Effektoren, also spezielle Proteine, die dafür sorgen, dass die Pflanzenabwehr den eindringenden Pilz nicht erkennt.
Pilzspezifische β-Glucane
Während über diese Mechanismen im Zusammenhang mit pilztypischem Chitin inzwischen einiges bekannt ist, gibt es für die am häufigsten vorkommenden Moleküle in den Zellwänden von Pilzen, die β-Glucane, bisher kaum Untersuchungen. β-Glucane kommen auch in Pflanzen vor, sind aber in einer spezifischen Bauart (β-1,3/1,6-Glucane) typisch für Pilze und daher ein geeigneter MAMP für das pflanzliche Immunsystem. Die Forscher interessierte daher, wie Pilze es schaffen, ihre Glucane für Pflanzen unkenntlich zu machen. Sie untersuchten den Pilz Piriformospora indica, einen Wurzelsymbionten, der sowohl mit einkeimblättrigen als auch zweikeimblättrigen Pflanzen Symbiosen eingeht. Um herauszufinden, wie Pflanze und Pilz aufeinander reagieren, untersuchten sie zunächst die Aktivität verschiedener Pilzgene beim Kontakt des Pilzes mit einem potentiellen Wirt, in diesem Fall Gerste (Hordeum vulgare) und Ackerschmalwand (Arabidopsis thaliana).

Auch die Modellpflanze Ackerschmalwand (Arabidopsis thaliana) profitiert von der Symbiose mit Piriformospora indica.
Bildquelle: © Vasiliy Koval / Fotolia.com
Untersucht wurden Gene, die sogenannte SSPs (Small Secreting Proteins) codieren, die als Effektoren dem Pilz helfen, die Pflanzenabwehr zu überlisten. Dabei entdeckten die Forscher das Protein FGB1 (Fungal Glucan Binding 1), das sowohl bei der Besiedlung der Gerste als auch der Ackerschmalwand auftrat. Da dessen Gen zudem homolog mit dem Gen einer anderen Pilzart ist, das bereits als potentieller Effektor bei der Besiedlung von Pflanzen beschrieben wurde, untersuchten die Forscher dieses Protein genauer.
Besuch mit Tarnumhang
Weitere Versuche zeigten, dass FGB1 hauptsächlich an β-1,3-gebundene Glucosepolymere der Pilzzellwand mit β-1,6 gebundenen Seitenzweigen bindet. Allerdings schützt FGB1 die β-Glucane nicht vor der Zerschneidung durch von der Pflanze freigesetzte Enzyme (β-Glucanasen), sondern verhindert offenbar die Entdeckung der pilztypischen β-Glucanstrukturen durch die Pflanze.
Die Zellwände des Pilzes werden bei der Besiedelung durch die β-Glucanasen in kleine Fragmente zerschnitten. Anschließend binden sie an spezielle β-Glucan-Rezeptorkomplexe der Pflanze. β-Glucan-Fragmente ohne FGB1 werden sofort als pilzspezifisch erkannt und es wird ein Oxidative Burst ausgelöst. β-Glucanreste mit FGB1 werden von der Pflanze offenbar nicht erkannt und die Immunabwehr bleibt aus. Die Forscher gehen davon aus, dass die an FGB1 gebundenen β-Glucanfragmente eine höhere Affinität zu den Rezeptorkomplexen haben als die freien β-Glucanreste, daher bevorzugt an die Rezeptoren binden und so eine Immunreaktion der Pflanze verhindern. Diese Art Tarnmechanismus hilft dem Pilz, unerkannt zu bleiben: Indem er seine eigene Zellwandstruktur verändert, wird diese für die Pflanze unkenntlich und der Pilz kann seine Besiedelung fortsetzen.
Wichtige Erkenntnisse
Das Wissen über β-Glucane als MAMPS ist bisher eher gering. Die Ergebnisse zeigen, dass β-Glucane eine wichtige Funktion bei der Erkennung von Pilzen haben und dass Pilze Strategien entwickeln, um β-Glucane vor der Entdeckung durch die Pflanze zu schützen. Diese Ergebnisse sind nicht nur für die Züchtung von Pflanzen mit verbesserter Abwehr von Pathogenen interessant, sondern auch – wie in diesem Fall – für ein verbessertes Verständnis der Kontaktaufnahme zwischen Pflanze und symbiontischem Pilz. Auch in der Medizin könnte FGB1 zur Diagnostik von Pilzinfektionen genutzt werden. Bis dahin müssen allerdings noch einige Wissenslücken geschlossen werden.
Quelle:
Wawra, S. et al. (2016): The fungal-specific β-glucan-binding lectin FGB1 alters cell-wall composition and suppresses glucan-triggered immunity in plants. In: Nature Communications, (27. Oktober 2016), doi: 10.1038/ncomms13188.
Zum Weiterlesen:
- Pflanzen-Pathogen-Interaktion
- Krankheitserreger ködern und bekämpfen - Wie Immunrezeptordomänen Resistenzen ermöglichen
- Nur gemeinsam sind sie stark - Forscher identifizieren wichtiges Molekül der pflanzlichen Immunantwort
- Hormonrezeptor reguliert, wie gut Pflanzen Krankheitserreger wahrnehmen
Titelbild: Gerste ist eine bekannte Wirtspflanze des Pilzes Piriformospora indica, mit dem sie eine Symbiose eingeht. (Bildquelle: © Johannes D./wikimedia.org; CC BY SA 3.0)
