Für mikronährstoffreichere Pflanzen
Den Zinkstoffwechsel verstehen

Linsen sind eine gute Zinkquelle. Zink erfüllt im menschlichen Körper viele wichtige Funktionen. Stoffwechsel, Immunsystem und Hormone sind auf diesen Mikronährstoff angewiesen. (Quelle: © iStockphoto.com/ UroshPetrovic)
Obwohl Zink außerordentlich wichtig für den menschlichen Körper ist, ist die Zinkversorgung in vielen Ländern der Erde nicht optimal. Wissenschaftler der Universität Bayreuth arbeiten daran, den Zinkstoffwechsel in Pflanzen aufzuklären, um die Versorgung mit Mikronährstoffen zu verbessern.
Zink erfüllt im menschlichen Körper viele verschiedene Funktionen. So nimmt es Schlüsselrollen im Zucker-, Fett- und Eiweißstoffwechsel ein und ist beteiligt am Aufbau der Erbsubstanz und beim Zellwachstum. Sowohl das Immunsystem als auch viele Hormone benötigen Zink für ihre Funktion. Doch nicht in allen Regionen der Erde enthält unsere Nahrung genug Zink, um den Körper ausreichend damit zu versorgen. Aber auch hierzulande greifen viele gerade in der Erkältungszeit zu Zinkpräparaten mit dem Ziel, die Immunabwehr des Körpers zu unterstützen.
Etwa jedes zehnte Protein braucht Zink für seine Funktion
Die Bioverfügbarkeit des Mikronährstoffes Zink war offenbar ein ausschlaggebender Faktor bei der Evolution der Eukaryoten. Als vor vielen Millionen Jahren die Ur-Ozeane zu oxidieren begannen, weil der Sauerstoffgehalt der Atmosphäre durch die vermehrte Photosynthese zunahm, löste sich im Wasser mehr Zink (Zn2+) und wurde von den Ur-Lebewesen auf der Erde immer mehr für ihren Stoffwechsel genutzt. Heute schätzt man, dass etwa 8 bis 10 Prozent aller Proteine in Eukaryoten Zink binden können. Bei den Bakterien und Archaeen sind es etwa 5 bis 6 Prozent. Damit gehört Zink zu den am meisten genutzten Mikroelementen in Eukaryoten. Zink-abhängige Proteine kommen in allen Enzymklassen vor, am häufigsten bei den Hydrolasen. Neben katalytischen Effekten, die Zink in Verbindung mit Enzymen hat, stabilisiert das Spurenelement auch die Struktur von Proteinen, wie beispielsweise in Zinkfingerdomänen.

In manchen Böden der Erde ist Zink Mangelware. Ernähren sich Menschen dauerhaft von Pflanzen, die zu wenig Zink enthalten, treten Mangelerscheinungen auf.
Bildquelle: © iStockphoto.com/ Stacey Newman
Zink ungleichmäßig verteilt
Zink gelangt in den Boden, indem zinkhaltige Mineralien langsam verwittern. „In vielen Böden der Welt ist zu wenig Zink im Boden, um ein optimales Pflanzenwachstum zu ermöglichen, wie beispielsweise in der Türkei“, so Prof. Clemens. Das sei ein Grund, warum vermehrt mit Zink gedüngt werde. In der Nähe von Metall verarbeitender Industrie kann jedoch auch das Gegenteil der Fall sein: Die Zinkkonzentrationen im Boden sind toxisch für die meisten Pflanzen.
Auf die Dosis kommt es an
Zu viel Zink kann toxisch wirken, denn Zink reagiert mit Stickstoff-, Sauerstoff und schwefelhaltigen, organischen Molekülen, wie beispielsweise Histidin, Asparagin- oder Glutaminsäure - den wichtigsten Zinkliganden bei Proteinen. Zink kann außerdem andere essentielle Kationen in biologischen Molekülen ersetzen und so, wenn es im Übermaß vorkommt, toxisch auf Zellen wirken. Während das Vorkommen von Zink im Boden oft großen Schwankungen unterliegt, wird seine Konzentration daher innerhalb der pflanzlichen Zelle relativ konstant gehalten. Dazu tragen Zink-Transporter und Zink-Chelat bildende Moleküle bei.
Den Zinkstoffwechsel aufklären
Um weitere Moleküle zu identifizieren, die die Zinkkonzentration innerhalb des pflanzlichen Gewebes aufrecht erhalten, führten Wissenschaftler der Universität Bayreuth zusammen mit Kollegen aus Österreich Versuche mit Zink-hypersensitiven Mutanten durch. Dabei wählten sie jene Pflanzen aus, die auf toxische Zink-Konzentrationen im Boden mit verkürzten Wurzeln reagierten. Dazu behandelten sie zu nächst die Samen von Arabidopsis-Pflanzen mit einem chemischen Mutagen. Dann ließen die Wissenschaftler etwa 24.000 Keimlinge in Gegenwart einer Zinkkonzentration wachsen, die bei Wildtyppflanzen zu etwa 40 % verkürzten Wurzeln führt. Sechs Pflanzen zeigten unter diesen Bedingungen ein noch eingeschränkteres Wurzelwachstum und wurden von den Forschern als Kandidaten ausgewählt. Denn bei diesen Pflanzen schien der Zinkstoffwechsel durch eine Mutation gestört zu sein. Weitere Versuche zeigten, dass drei der Pflanzen lediglich auf die Anwesenheit von Zink in ihrem Nährmedium mit verkürztem Wurzelwachstum reagierten, die anderen auch auf andere Metalle. Das ließ die Wissenschaftler vermuten, dass bei ihren sechs Pflanzen offenbar verschiedene Mechanismen zur Zinktoleranz beschädigt sein mussten.
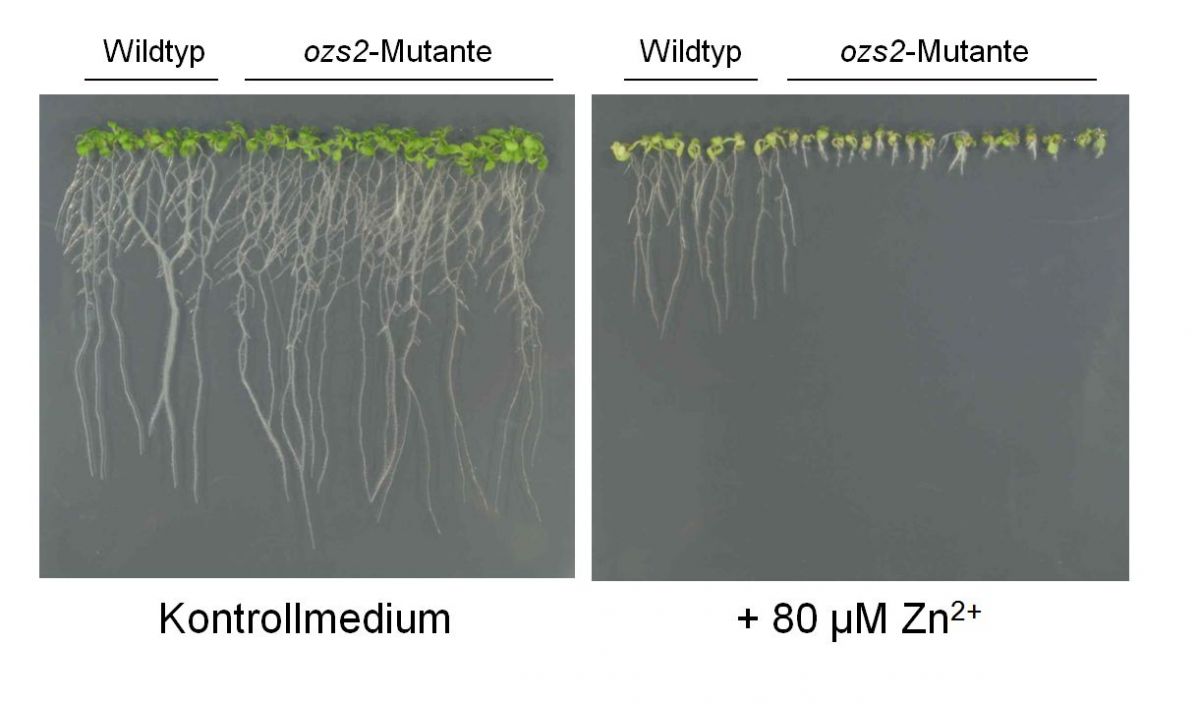
Die Ergebnisse der Versuche mit Zink-hypersensitiven Mutanten.
Bildquelle: © Michael Weber
Transporter parkt Zink in Zellvakuole
Als die Forscher das Erbgut der Pflanzen analysierten, zeigte sich, dass jede Pflanze an einem anderen Genort mutiert war. Die beiden Mutanten, die am stärksten auf Zink reagierten, nahmen die Forscher näher unter die Lupe. Bei Mutante ozs1 (overly Zn sensitive) war der bereits bekannte Vakuolen-Zn-Transporter AtMTP1 defekt. „Dieses Protein sorgt dafür, dass die Zinkkonzentration in der Zelle nicht zu hoch wird. Dringt zu viel Zink in die Zelle ein, sorgt dieses Protein dafür, dass es in der Zellvakuole gespeichert wird“, so Prof. Dr. Stephan Clemens vom Lehrstuhl für Pflanzenphysiologie der Universität Bayreuth, Hauptautor der Studie.
Ladung der Zellwand wichtig für Zinkaufnahme
Bei Mutante ozs2 arbeitete das Enzym Pektin Methylesterase3 (AtPME3) nicht korrekt. „Die genaue Funktion dieses Enzyms ist bisher noch nicht bekannt. Wir wissen aber, dass diese Gruppe von Enzymen die Zellwandeigenschaften verändern“, so Prof. Clemens. Pflanzliche Zellwände enthalten unter anderem Pektine, die negative Ladungen an ihren Oberflächen tragen können, wenn sie nicht durch Methylreste maskiert sind. „Die Ladung der Zellwand spielt eine Rolle bei der Interaktion mit metallischen Ionen, die positiv geladen sind“, erklärt Prof. Clemens. Wie die Versuche zeigten, führt eine Mutation in AtPME3 dazu, dass die betreffenden Pflanzen sehr empfindlich auf Zink reagieren. Prof. Clemens und sein Team vermuten, dass dahinter eine bisher nicht bekannte Modulation der Zellwand liegt. Salz, osmotischer und oxidativer Stress konnten das Wurzelwachstum dieser Mutante aber nicht beeinflussen. Daraus schlossen die Wissenschaftler, dass es sich bei der vorliegenden Mutation offenbar nur eine Hypersensitivität gegenüber Zink auslöste.
Die Zinkversorgung verbessern
Neben der Grundlagenforschung zum Zinkstoffwechsel in Pflanzen zielt Prof. Clemens Forschung auch auf eine praktische Anwendung, die er unter dem Begriff „Biofortifikation“ zusammenfasst: „Weltweit gibt es zahlreiche zinkarme Böden. Global betrachtet nehmen sehr viele Menschen zu wenig Zink auf. Das liegt daran, dass die Pflanzen, die uns als Nahrungsmittel dienen, zu wenig Zink enthalten“, so Prof. Clemens. „Erst wenn wir verstehen, wie Zink in die Pflanze gelangt und dort verteilt wird, können wir diesen Kreislauf für die menschliche Ernährung vorteilhaft beeinflussen.“
Quelle:
Weber, M. et al. (2013): A mutation in the Arabidopsis thaliana cell wall biosynthesis gene pectin methylesterase3 as well as its aberrant expression cause hypersensitivity specifically to Zn. In: Plant Journal, (5.Juli 2013), [Epub ahead of print], doi:10.1111/tpj.12279.
Zum Weiterlesen auf Pflanzenforschung.de:
- "Gezinkter" Weizen
- Wie kann die Weltbevölkerung 2050 ernährt werden?
- NanoMetalle – Risiko für den Ackerbau?
Titelbild: Linsen sind eine gute Zinkquelle. Zink erfüllt im menschlichen Körper viele wichtige Funktionen. Stoffwechsel, Immunsystem und Hormone sind auf diesen Mikronährstoff angewiesen. (Quelle: © iStockphoto.com/ UroshPetrovic)
