Wie CRISPR/Cas funktioniert
Eine einfache Technologie verbessert die Effizienz der Genom Editierung
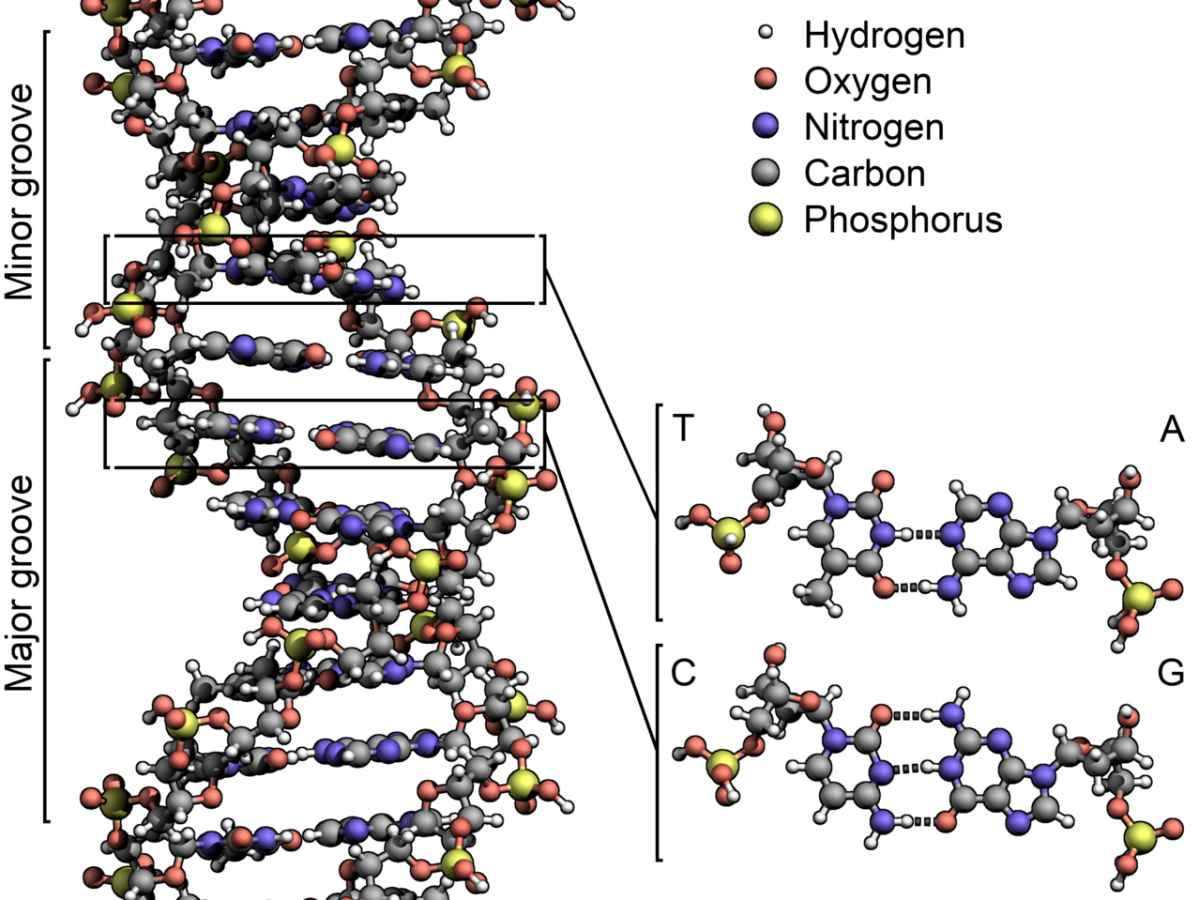
DNA enthält lebenswichtige Informationen, doch viel ist noch nicht verstanden. Neue Technologien für die Editierung des Genoms, wie das CRISPR/Cas9-System, sollen bei der Aufklärung helfen. (Bildquelle: © Zephyris / wikimedia.org; CC BY-SA 3.0)
Die Beschreibung des CRISPR/Cas9-Systems im Jahr 2012 hat eine Revolution in Gang gesetzt, welche die Grundlagenforschung genauso wie die Anwendung in Medizin, Landwirtschaft und Ökologie erreicht. Die Erfinderinnen werden wie Stars gefeiert und um die Verwertungsrechte ist bereits ein Konflikt entbrannt. Tatsache ist, dass die Technologie ein enormes Potential, aber potentiell auch Gefahren mit sich bringt. Wir nehmen die Genom Editierung mit Hilfe von CRISPR/Cas9 unter die Lupe.
Erbgutinformationen müssen stabil genug sein, um an die Nachkommen ohne unerwünschte Änderungen weitergegeben zu werden, jedoch gleichzeitig plastisch genug, um mit anderen Molekülen zu interagieren und durch zelleigene Mechanismen verdoppelt, abgelesen und modifiziert zu werden.
DNA bleibt ein seltsames Molekül
DNA befindet sich in jeder Zelle jedes Organismus und ist, obwohl sie einen repetitiven Aufbau sowie eine überschaubare Struktur aufweist, für die Vielfalt aller Lebewesen maßgeblich. Betrachtet man ausschließlich die DNA-Sequenz, lassen sich die enormen äußerlichen Unterschiede kaum nachvollziehen. So sind beispielsweise die DNA-Sequenz des Menschen und jene der Maus zu ca. 97,5 Prozent identisch.
Nichts ist für die Existenz eines Organismus so entscheidend wie DNA – ausgenommen das Schicksal selbst. Nicht umsonst wird sie penibel gewartet und eifrig verteidigt. Die Verteidigungsmechanismen sind in Prokaryoten am besten charakterisiert und werden seit Jahrzehnten in der Biotechnologie genutzt, um gezielte Änderungen an der DNA vorzunehmen. Solche Veränderungen sind eine wichtige Voraussetzung, um die Funktion von Genen zu erforschen, aber auch um neue genetische Variation zu erzeugen.

Mehr Schein als Sein: Trotz enormen äußerlichen Unterschieden ist die DNA-Sequenz des Menschen und die der Maus zu ca. 97,5 Prozent identisch. Doch wie kann man das erklären? Die Genom Editierung kann Antworten liefern.
Bildquelle: © iStock.com/ zoshyii
Zurück zum ATGC
Spätestens seit Darwin die Evolutionstheorie und Mendel die Vererbungsregeln Mitte des 19. Jahrhunderts formulierten, versucht man, die Kausalität zwischen Phänotyp und Genotyp aufzuklären. Die Entdeckung der Doppelhelix und die Fortschritte in der Molekularbiologie lieferten wichtige Beiträge dazu.
Müll nicht links liegen lassen
Jedoch ist noch lange nicht alles aufgeklärt. Der größte Teil der DNA aller Lebewesen kodiert nicht für Proteine und hat eine unbekannte Funktion. Lange Zeit wurde solche DNA als „Müll“ bezeichnet (Eng.: „junk DNA“). Zunehmend wird die Wichtigkeit dieser nicht-kodierenden DNA erkannt – sowohl in Menschen als auch in Tieren, Pflanzen, Pilzen und Mikroorganismen.
Mit der Genom Editierung (engl. Genome Editing) – also der gezielten Modifikation der DNA-Sequenz mittels zelleigener Enzyme, den Nukleasen – wurde ein Methodenspektrum entwickelt, das es erlaubt, das große Unbekannte der DNA zu erforschen. Denn nur wenn es möglich ist, jede einzelne Base gezielt zu verändern, können die noch unbekannten Funktionen beeinflusst, erkannt und verstanden werden. Alle bisher etablierten Methoden waren begrenzt, teuer und langwierig.
Das neueste Tool für das Genome Editing
Das kürzlich beschriebene CRISPR/Cas-System in Prokaryoten, insbesondere jenes des Modellbakteriums Streptococcus pyogenes, erweist sich als eine der bedeutendsten Instrumente des Genome Editings. Ironischerweise wurde auch die CRISPR-DNA lange Zeit als Schrott angesehen.
CRISPR steht für „clustered regularly interspaced short palindromic repeats”. Schon vor knapp 30 Jahren entdeckten Forscher, dass sich im Genom des Bakteriums E. coli repetitive DNA-Sequenzen anhäufen. Sie sind kurz und zum Teil sowohl vorwärts als auch rückwärts lesbar (palindromisch). Noch spannender ist aber die Tatsache, dass sich zwischen diesen Palindromen „Spacers“ (zu Deutsch Distanzstücke) befinden, die nichts anders sind als DNA-Sequenzen aus Viren. Doch blieb die Funktion dieser CRISPR-Sequenzen lange unbekannt.
Erst als Wissenschaftler feststellten, dass CRISPR-DNA tatsächlich transkribiert wird und sich stets in der Nähe von sogenannten cas-Genen befindet, die für Eiweiße mit einer Helikase als auch Nuklease-Aktivität kodieren, begann sich das Blatt zu wenden. „Cas“ steht für „CRISPR associated“ - mit CRISPR verbundene Gene. Durch die Kombination aus Helikase- und Nuklease-Aktivität können die durch diese Gene kodierten Cas-Proteine Doppelstränge von Nukleinsäuren trennen und die DNA zerschneiden.
Kurze Geschichte der Entdeckung des CRISPR/Cas9-Systems
1987: CRISPR-DNA im Modellbakterium E. coli entdeckt. Die Funktion ist unbekannt.
2005: Formulierung der Hypothese, dass das CRISPR-System eine Verteidigung gegen Viren ist.
2007: CRISPR/Cas-Systeme sind eine adaptive Immunabwehr von Bakterien gegen Viren.
2010: Typ II CRISPR/Cas-System schneidet doppelsträngige DNA.
2011: Cas9 allein reicht für die Interferenzphase des Typ II CRISPR/Cas-Systems.
2012-2013: Das System kann umprogrammiert werden und ist in Eukaryoten funktionsfähig.
2013-2015: CRISPR/Cas9 erweist sich als ein revolutionares Werkzeug für die Genom Editierung.
(Quelle: Bearbeitet aus Doudna & Charpentier (2014), Science 346(6213):1258096.)
Spuren früherer Schlachten
Mit diesem Wissen um die Funktion dieser „Müll-DNA“ wurde eine spannende Hypothese formuliert: Könnte es sich bei dem CRISPR-System vielleicht um ein Verteidigungsmechanismus handeln, mit dem sich nicht nur E.coli Bakterien, sondern auch andere Bakterien, vor Virenbefall wappnen? Sind die eingeschlossenen Spacers nichts anderes als die Spuren früherer Kämpfe zwischen Bakterium und Virus?
CRISPR/Cas – ein adaptives Immunsystem gegen Viren
Die Antwort: Ja. Im Gegensatz zu angeborenen Abwehrenzymen, die fremde DNA zwar spezifisch, jedoch nur an bestimmten Stellen schneiden, wird das CRISPR-System durch Kontakt mit Viren in der Bakterienzelle erweitert. Es gilt als adaptives Immunsystem – eine Art Gedächtnismechanismus auf molekularer Ebene. Nach dem ersten Kontakt, kann die Zelle das Virus erkennen und mithilfe von spezifischen „molekularen Scheren“ abwehren.
Doch was passiert genau? Werden Bakterien oder Archaeen mit Viren infiziert, können sie die virale DNA in die CRISPR als neue „Spacer“ einfügen, um zu einem späteren Zeitpunkt, aufgrund der Paarungsregel der Nukleinsäuren, das Virus zu erkennen. Mithilfe von den Cas-Proteinen können die genetischen Informationen des Eindringlings abgebaut und die Gefahr einer feindlichen Übernahme neutralisiert werden.
Das Prinzip ähnelt der bei Tieren und Pflanzen bekannten RNA-Interferenz. In Bakterien der Art S. pyogenes ist dieses jedoch so stark vereinfacht, das ein einziges RNA-Molekül und das Enzym Cas9 als Schutz genügen.
Wie das CRISPR/Cas-System funktioniert
Überlebt ein Prokaryot eine Virusattacke, wird der CRISPR/Cas-Verteidigungsmechanismus in Gang gesetzt. Aufgrund der involvierten Cas-Proteine und des Erkennungsmechanismus fremder DNA unterscheidet man heute drei CRISPR/Cas-Systeme. Die Funktionsweise ist bei allen drei Systemen jedoch ähnlich. Den Prozess kann man in drei Phasen einteilen:
- Phase 1 (Akquisitionsphase): Die Bakterienzelle fügt einen neuen „Spacer“ in der CRISPR-DNA ein.
- Phase 2 (Bearbeitungsphase): Nach der Transkription der CRISPR-DNA entsteht zunächst pre-crRNA. Diese wird anschließend in crRNA (CRISPR RNA) bearbeitet.
Ein Teil der crRNA ist komplementär zur Ziel-DNA und kann diese somit „erkennen“. Bei S. pyogenes ist für die Phase das RNA-Molekül tracrRNA notwendig. crRNA und tracrRNA paaren sich und bilden ein crRNA:tracrRNA-Duplex. Diese Duplex-Einheit kann sowohl an Cas9 als auch an der eingedrungenen Ziel-DNA (die DNA des Virus) binden.
- Phase 3 (Interferenzphase): Cas-Proteine schneiden die virale DNA auf beiden DNA-Strängen. Diese Funktion übernimmt bei S. pyogenes Cas9. Die Interferenzphase hinterlässt einen DNA-Doppelstrangbruch in der Ziel-DNA. Die sogenannte PAM-Erkennungssequenz in der unmittelbaren Nähe der Ziel-DNA stellt sicher, dass nur die fremde DNA geschnitten wird.
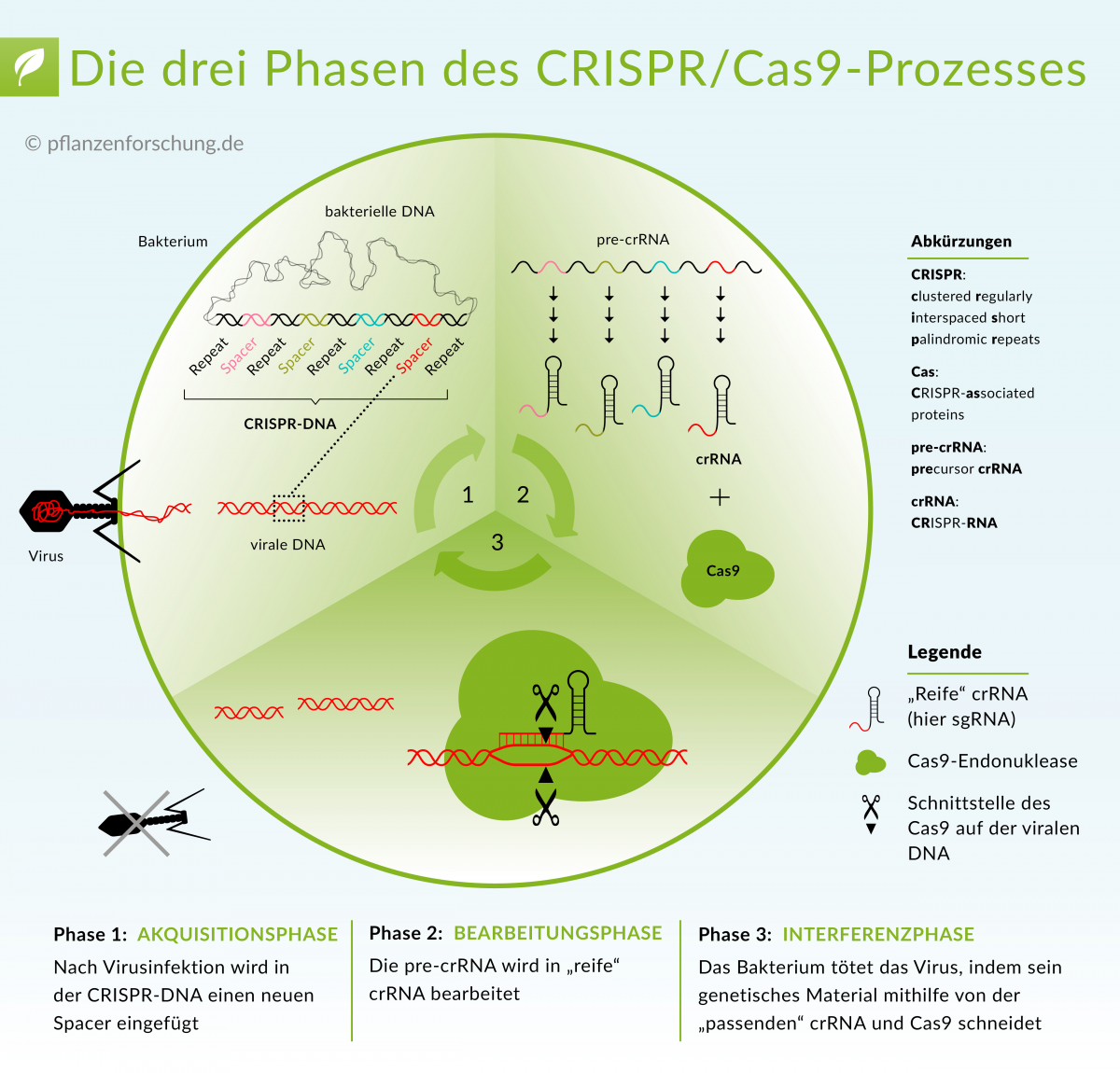
Die Funktionsweise des Typ II CRISPR/Cas-Systems. Der Ablauf des Prozesses erfolgt in drei Phasen: Akquisition eines neuen Distanzstückes, Bearbeitung der pre-crRNA in cr-RNA, Abbau der viralen DNA.
Bildquelle: © Pflanzenforschung.de
CRISPR/Cas9 als universelle molekulare Schere
Cas9 ist ein Protein mit mehreren Domänen und Aktivitäten. Die HNH-Domäne ist in der Lage, das doppelsträngige RNA:DNA-Hybrid zwischen crRNA und Target-DNA-Strang zu zerschneiden, während die RuvC-Domäne, der zweite, nicht gepaarte Strang der Target-DNA angreift. Der DNA-Doppelstrangbruch ist tödlich für Viren, die nicht in der Lage sind, das eigene Erbgut zu reparieren.
Andere Organismen – der Mensch inbegriffen – beherrschen eine solche Reparatur der Erbsubstanz. Dieser zelleigene Reparaturmechanismus geschädigter DNA-Moleküle bildet die Grundlage für das Genome Editing.
DNA Schnitte einfacher und gezielter setzen
Die Steuerung von Cas9 auf die „richtige“ Stelle in der DNA, der zentrale Aspekt des Genome Editings, basiert auf der Paarung zwischen crRNA und Ziel-DNA, also nicht, wie bei Zinkfingernukleasen oder TALENs, auf Wechselwirkungen von Proteinen und DNA. Damit entfällt ein langwieriger und ungewisser Prozess, um die DNA zerschneidenden Nukleasen an der gewünschten Stelle im Genom in Stellung zu bringen.
Das System wird umprogrammiert
Unter der Leitung von Jennifer Doudna und Emmanuelle Charpentier zeigten Jinek et al. im Jahr 2012, sowie unabhängig von ihnen die Gruppe um Luciano Marraffini und Feng Zhang, wie das Typ II CRISPR/Cas9-System von S. pyogenes umfunktioniert werden kann, um jede beliebige DNA-Sequenz, also nicht nur Virus DNA, gezielt zu schneiden.
Bei der weiteren Charakterisierung des Proteins Cas9 stellten die Forscher fest, dass bereits ein einziges RNA-Molekül (sgRNA) das Molekülpaar crRNA:tracrRNA ersetzen kann. Diese künstliche RNA erlaubt eine Vereinfachung des Systems. Das sgRNA-Molekül lässt sich quasi auf Wunsch bestellen und ca. 20 Nukleotide davon sind ausreichend, um jede beliebige DNA-Sequenz spezifisch zu erkennen.
Von erheblicher Bedeutung für die Revolution in der Forschung durch das Genome Editing ist die Tatsache, dass Cas9 nicht nur in Prokaryoten aktiv ist - das System somit auch in Pilzen, Pflanzen und Tieren voll funktionsfähig ist.
Die Präzision des Cas9-Proteins erlaubt eine genauere Überarbeitung der DNA. Dafür wird es nicht mehr nötig, große DNA-Abschnitte, mitunter Genmarker oder artfremde Gene, während des gentechnischen Prozesses hinzuzufügen. Mit CRISPR/Cas-modifizierte Zellen gelten somit nicht automatisch als gentechnisch veränderte Organismen (GVO).
Jennifer Doudna und Emmanuelle Charpentier nehmen im Dezember 2014 den "Breakthrough Prize" 2015 in den Naturwissenschaften in Kalifornien entgegen.
Videoquelle: © youtube.com / Breakthrough Prize
Zwei Wissenschaftlerinnen werden zu Stars
Obwohl erst 2012 beschrieben, werden die Erfinderinnen des CRISPR/Cas9-Systems schon jetzt als Stars gefeiert. Jennifer Doudna an der University of California, Berkeley, und Emmanuelle Charpentier, die ab dem 1. Oktober 2015 Direktorin des Max-Planck-Instituts für Infektionsbiologie in Berlin ist, schafften es bereits in diesem Jahr in die "TIME 100 Liste". Diese Liste des US-amerikanischen Time Magazins benennt die nach ihrer Meinung 100 einflussreichsten Persönlichkeiten der Welt.
Ebenfalls im Jahr 2015 gewannen sie den mit je 3 Millionen US-Dollar dotierten Breakthrough Prize in Life Sciences. Dieser seit 2013 vergebene Preis für bahnbrechende Forschungsleistungen in Biowissenschaften und Medizin wird unter anderem vom Facebook-Gründer Mark Zuckerberg und Sergey Brin von Google gestiftet.
Es ist nicht übertrieben zu spekulieren, dass sie in den nächsten Jahren einen Nobel-Preis erhalten könnten. Denn mit dem von ihnen zur funktionsreife entwickelten Genom-Veränderung werden die vom Stifter des Nobelpreises definierten Grundsätze erfüllt. Alfred Nobel definierte in seinem Testament, dass der Preis denen zuteil werden solle, die in den verflossenen Jahren der Menschheit den größten Nutzen geleistet haben. Mit der CRISPR/Cas-Methode wird nicht nur die medizinische, sondern die gesamte biologische Forschung bahnbrechend verändert.
Die Kombination aus einfacher Erkennung und spezifischer sowie steuerbarer Durchtrennung der DNA in prinzipiell allen Lebewesen durch das CRISPR/Cas9-System ist revolutionär. Damit steht fest: CRISPR ist alles anderer als zellulärer Schrott.
Quellen:
- Doudna, J.A. & Charpentier, E. (2014): The new frontier of genome engineering with CRISPR-Cas9. In: Science 346(6213):1077. (28. November 2014). doi: 10.1126/science.1258096.
- Cong, L. et al. (2013): Multiplex Genome Engineering Using CRISPR/Cas Systems. In: Science 339(6121):819-823 (3. Januar 2013). doi: 10.1126/science.1231143.
- Jinek, M. et al. (2012): A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity. In: Science 337(6096):816-21 (17. August 2012). doi: 10.1126/science.1225829.
Zum Weiterlesen auf Pflanzenforschung.de:
- Was CRISPR/Cas leisten kann - Der Editierung von Genomen scheinen technologisch kaum noch Grenzen gesetzt
- Gibt es neben Chancen auch Risiken von CRISPR/Cas9?
- Gentechnisch veränderte Pflanzen der zweiten Generation - GV-Pflanzen sind nicht mehr von traditionellen Züchtungsprodukten zu unterscheiden
- Cas9 – ein molekularbiologisches Mikroskalpell - Bakterielle Abwehr umfunktioniert
- Lexikon-Beitrag zum Genome Editing
Weiterführende Informationen:
- Factsheet: Das CRISPR/Cas-System
- Stellungnahme der Leopoldina (2015): "Chancen und Grenzen des genome editing"
Titelbild: DNA enthält lebenswichtige Informationen, doch viel ist noch nicht verstanden. Neue Technologien für die Editierung des Genoms, wie das CRISPR/Cas9-System, sollen bei der Aufklärung helfen. (Bildquelle: © Zephyris / wikimedia.org; CC BY-SA 3.0)
