Zinkfinger-Nukleasen
Molekulare Werkzeuge für die Pflanzenzucht

Zinkfingernukleasen sind die Präzisionswerkzeuge der Pflanzenzüchter (Quelle: © iStockphoto.com/Andreas Reh).
Wer Zinkfinger-Nukleasen im Schrank hat, kann auf den grünen Daumen getrost verzichten. Die viel versprechenden Werkzeuge der Pflanzenzüchter ermöglichen gezielte Mutationen im pflanzlichen Erbgut oder den exakten Einbau eines Transgens. Ob und wenn ja welche so erzeugten Pflanzen als „gentechnisch verändert“ eingestuft werden, ist noch nicht entschieden.
In loser Folge stellt Pflanzenforschung.de ausgewählte neue Züchtungsmethoden vor. Im ersten Beitrag widmen wir uns den Zinkfinger-Nukleasen.
Vor etwa zehntausend Jahren, als die Menschen die besten Pflanzen aus dem Feld für die nächste Aussaat auswählten, begann die Züchtung von Pflanzen. Doch erst durch Gregor Mendels Entdeckung (Mendelsche Regeln) und die damit verbundene Begründung der Genetik vor etwa 150 Jahren wurde die kontrollierte Fortpflanzung von Pflanzen mit dem Ziel der genetischen Umformung erheblich beschleunigt. Auf die Kreuzungszüchtung folgte die Hybridzüchtung in den 1930er Jahren, Zell- und Gewebekulturtechniken in den 1960er Jahren, rekombinante DNA-Techniken und genetisches Engineering in den 1980ern. Mit dem Aufkommen neuer DNA-Sequenzierungsmöglichkeiten entwickelte sich in den 1990ern das sog. „Smart Breeding“. Die modernen Züchtungsmethoden haben die alten jedoch keinesfalls abgelöst. Die heutige Pflanzenzüchtung profitiert von einer Mischung aus traditionellen und molekularbiologischen Methoden.
Pflanzenzüchtung ist ein langwieriges Unterfangen, das je nach gewünschter Eigenschaft und Art der Pflanze bis zu 15 Jahre, bei Obstbäumen sogar bis zu 50 Jahre, dauern kann. Der Prozess beginnt, indem der Züchter eine neue genetische Variation erzeugt, wenn diese nicht natürlich vorkommt. Dies kann entweder durch Kreuzung, durch chemische oder physikalische Mutagenese, durch Protoplastenfusion oder aber auch durch eine neue Züchtungsmethode wie der Zinkfinger-Nukleasen-Technologie (ZFN) geschehen.
Treffsichere Mutationen oder gezielter Geneinbau
Der Ort künstlich erzeugter Mutationen im Genom einer Pflanze liessen sich bisher nur unzureichend steuern. Und auch bei transgenen Pflanzen war bisher nicht planbar, wo das eingeschleuste neue Gen ins Erbgut eingebaut werden würde. Schob es sich beispielsweise in einen für die Zelle lebenswichtigen Abschnitt hinein, konnte das den Tod der Zelle bedeuten – oder aber ihre Entartung, wenn es beispielsweise ein Kontrollgen für die Teilung erwischte. Mit den Zinkfinger-Nukleasen haben Wissenschaftler ein gentechnisches Werkzeug entwickelt, mit dem sie sowohl zielgerichtete Mutationen im Genom hervorrufen, als auch den Einbauort eines neuen Gens zielsicher steuern können.
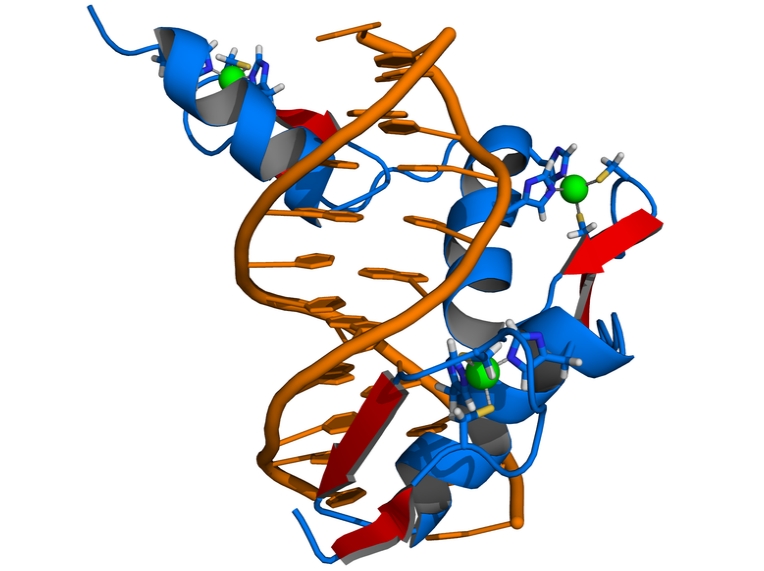
Die Schematische Darstellung zeigt die Bindung eines Zinkfingerproteins (blau) an die doppelsträngige DNA (orange). Die hier abgebildete Zinkfingernuklease besteht aus drei Zinkfingermotiven. Die roten Pfeile weisen auf die spezi-fischen Bindungsstellen zwischen den Proteinresten des Zinkfingermoleküls und der DNA hin. Grün dargestellt sind Zinkionen (Quelle: © Thomas Splettstoesser / wikipedia.org).
Aufspüren und schneiden
Zinkfinger-Nukleasen sind künstlich hergestellte Restriktionsenzyme. Das Prinzip ist einfach: Die Zinkfinger-Domäne bindet an die DNA, die Nukleasen-Domäne schneidet sie - aber nicht irgendwo. Wie Wärme suchende Raketen sind Zinkfinger-Nukleasen so designt, dass sie präzise vorbestimmte DNA-Abschnitte aufspüren und schneiden können. Das gelingt ihnen mit einer Art Navigationssequenz, einem kurzen DNA-Stück, mit dem sie sich an ganz bestimmten Stellen im Erbgut anheften – und zwar nur dort. Die Bindespezifität dieses Bereichs kann im Labor gezielt verändert und an ausgewählte Ziele angepasst werden. So können Wissenschaftler und Züchter nahezu jede Stelle im Genom gezielt manipulieren.
Vorübergehend oder stabil
Da Zinkfinger-Nukleasen Heterodimere sind, müssen zwei Gene in die Pflanzenzelle eingebracht werden. Das geschieht normalerweise mit Hilfe eines Expressionsplasmids, wenn gewünscht auch zusammen mit einem DNA-Stück, das in das Erbgut der Pflanze eingebaut werden soll. Um das alles in die Pflanzenzelle zu schleusen, haben Forscher je nach Pflanzenart unterschiedliche Möglichkeiten: Bei manchen klappt der Transfer besonders gut durch eine Elektroporation, bei anderen durch virale Vektoren oder mit Hilfe von Agrobakterien.
In der Zelle angekommen, kann der DNA-Code für die Zinkfinger-Nuklease entweder transient, also nur vorübergehend, von einem Plasmidvektor aus in ein aktives Protein übersetzt werden. Jedoch erzeugt die Zinkfinger-Nuklease stabil vererbte Mutationen im Genom der Pflanzenzelle. Durch die transiente Expression wird der Plasmidvektor mit dem DNA-Code für die Zinkfinger-Nuklease nach getaner Arbeit von der Zelle abgebaut.
Alternativ können Zinkfinger-Nukleasen auch als Transgene in das Genom der Pflanzenzelle integriert werden. In diesem Fall wird es unter den Nachkommen dieser Pflanzen immer noch Individuen geben, die das Zinkfinger-Nuklease-Gen stabil in ihrem Genom integriert haben. Derzeitig untersuchen Wissenschaftler auch, wie man Zinkfinger-Nukleasen direkt als Protein in die Zelle schleusen könnte.
Drei verschiedene Varianten der Zinkfinger-Nuklease-Technologie (ZNF1 bis ZNF 3) haben sich unter den Pflanzenzüchtern etabliert:
ZFN-1: Gene, die für eine ZFN kodieren, werden ohne eine Reparatur-DNA-Sequenz in die Pflanzenzelle eingebracht. Die ZNFs binden an die Pflanzen-DNA und erzeugen dort zielgerichtete Doppelstrangbrüche. Der natürliche DNA-Reparaturmechanismus (durch Verbinden der nicht homologen Enden) führt zu zielgerichteten Mutationen in einem oder wenigen Basenpaaren, oder zu kurzen Deletionen oder Insertionen. Pflanzliche Gene können so gezielt verändert oder blockiert werden.
ZFN-2: Gene, die für eine ZFN kodieren, werden zusammen mit einer Reparaturmatrize, die homolog zu einem bestimmten DNA-Abschnitt ist und einige Kilobasenpaare lange ist, in die Pflanzenzelle geschleust. Die ZFN binden an die Pflanzenzell-DNA und verursachen dort Doppelstrangbrüche. Die natürlichen Gen-Reparaturmechnismen erzeugen zielgerichtete Punktmutationen, beispielsweise Veränderungen einer oder mehrere Basenpaare durch homologe Rekombination und durch das Kopieren der Reparaturmatrize.
ZFN-3: Gene, die für eine ZFN kodieren, werden zusammen mit einem Stück DNA, das mehrere Kilobasenpaare lang sein kann und dessen Enden homolog zum DNA-Abschnitt der Schnittstelle sind, in die Zelle eingeschleust. Das DNA-Stück wird dann zielgerichtet und stabil in das Genom der Pflanzenzelle integriert.
Die Identifikation derart gezüchteter Pflanzen als transgene Pflanzen ist nur bei der ZFN-3-Methode möglich. Aus technischen Gründen können durch ZFN-1 und ZFN-2 erzeugte Pflanzen nicht als gentechnisch veränderte Organismen identifiziert werden und sind von konventionellen Züchtungsprodukten (z. B. durch Mutationszüchtung wie TILLING nicht unterscheidbar.
Vorteile der ZFN-Technologie
Bisherige Versuche, das Erbgut einer Pflanze gezielt zu verändern, waren extrem aufwendig und zeitraubend. Die eingesetzten Mutagene veränderten das pflanzliche Erbgut nämlich an einer nicht vorhersehbaren Stelle. Um genau diejenigen Individuen mit den gewünschten Eigenschaften zu finden, mussten Züchter oft Tausende von Pflanzen aufziehen und untersuchen. Mit der ZFN-Technologie hingegen steigerten Forscher den Anteil korrekt veränderter Pflanzen in einigen Versuchen sogar auf über 50 %.
Obwohl die ZFN-Technologie selbst noch nicht Routine und relativ aufwendig ist, ermöglicht sie trotzdem eine enorme Reduktion des Gesamtaufwandes bei der gezielten Genom-Veränderung. Die Methode, die bislang nur bei tierischen und menschlichen Zellen angewandt wurde, erleichtert es Forschern nicht nur, neue Gene einzufügen, sondern auch existierende zu verändern oder zu blockieren. Zudem können gleich mehrere Genveränderungen auf einmal in einer Pflanzensorte erreicht werden.
Und in der Praxis?
Laut einer Studie des Joint Research Center (JRC) der Europäischen Kommission von 2011 hat die ZFN-Technologie den Sprung aus den Forschungslaboren zu den kommerziellen Pflanzenzüchtern noch nicht ganz geschafft. Das mag auch an den bisher noch geringen Mutationsraten, erzeugt durch die ZNF-1 und ZNF-2 Technologie, liegen. Die an der Studie teilnehmenden Pflanzenzucht-Unternehmen gaben an, die ZFN-Technologie bei der Manipulation von Mais, Raps und Tomaten anzuwenden. Hauptsächlich geht es um die Erzeugung herbizidresistenter Pflanzen, aber auch um die Beseitigung von sog. Antinährstoffen und Allergenen durch Gen-Knock-Out und das Entfernen von antibiotischen Markern. Laut der Erzeuger könnten die ersten derartig gezüchteten Pflanzen in zwei bis drei Jahre marktreif sein, es sei denn, sie fallen laut Gentechnikgesetz nicht unter den Begriff „gentechnisch veränderte Organismen“.
Die Definition für gentechnisch veränderte Organismen wurde im Jahr 1990 formuliert und seitdem nicht verändert. Im Jahr 2007 gründete die Europäische Kommission daher eine Arbeitsgruppe, die moderne Pflanzenzuchtmethoden wie die ZFN-Technolgie und deren Produkte neu bewerten soll. Falls es sich bei den so gezüchteten Pflanzen um gentechnisch veränderte Organismen handelt, bedeutete dies für die Vertreiber einen erheblichen finanziellen Mehraufwand für deren Zulassung und eine geringe Akzeptanz in der Bevölkerung.
Quellen:
- Maria Lusser et al. (2011): New plant breeding techniques - State-of-the-art and prospects for commercial development. In: JRC Report, EUR 24760 EN - 2011; 9 789279 197154.
- Vipula K. Shukla et al. (2009): Precise genome modification in the crop species Zea mays using zinc-finger nucleases. In: Nature 459:437-441 (Abstract).
- Jeffrey A. Townsend et al. (2009): High-frequency modification of plant genes using engineered zinc-finger nucleases. In: Nature 459:442-445 (Abstract).
- Zinc Finger Consortium Website
Zum Weiterlesen:
- Zum Methodenbericht des JRC: „Biotechnologische Züchtungsverfahren der nächsten Generation“
