Photosynthese 2.0
Von der Jagd nach mehr Effizienz bis zum künstlichen Blatt

Blätter fixieren CO2, um daraus in der Photosynthese Kohlenhydrate herzustellen. (Bildquelle: © Josch13/Pixabay/CC0)
Die Photosynthese gehört zu den wichtigsten biochemischen Prozessen unserer Erde. Pflanzen binden damit das Treibhausgas CO2 und bilden daraus Biomasse, die wir als Lebensmittel, Futtermittel und nachwachsende Rohstoffe benötigen. Als Nebenprodukt entsteht auch noch der für uns lebenswichtige Sauerstoff. Doch trotz ihrer zentralen Bedeutung für das Leben auf unserem Planeten läuft die Photosynthese erstaunlich ineffizient ab. Genau hier setzen die Bemühungen der Forschenden an. Die Photosynthese soll effizienter werden, um mehr Lebensmittel, fossilfreie Energieträger und Rohstoffe produzieren zu können. Das wäre auch ein Durchbruch für den Klimaschutz.
Die Photosynthese entstand vor etwa 3 Milliarden Jahren, reicherte unsere Atmosphäre zunehmend mit Sauerstoff an und ermöglichte so die Vielfalt des Lebens auf der Erde. Heute hängt fast die gesamte Biomasseproduktion von diesem Stoffwechselweg ab, der in Cyanobakterien und in den Chloroplasten von höheren Pflanzen und Algen stattfindet. Und damit auch die Produktion von Grundnahrungsmitteln wie Reis, Mais, Weizen und Soja, die sich aufgrund der weiter wachsenden Weltbevölkerung deutlich erhöhen muss.
Doch erstaunlicherweise ist die Photosynthese ein ineffizienter Prozess mit niedrigen Wirkungsgraden, denn Pflanzen wandeln nur einen geringen Teil des Sonnenlichts in chemische Energie um. Der Wirkungsgrad der Nettoprimärproduktion liegt – in Abhängigkeit von den Umweltbedingungen – bei nur mageren 0,5 bis 1,5 Prozent. Eine deutliche Optimierung der Photosynthese wäre daher der Jackpot, um unsere Kulturpflanzen produktiver zu machen – zumal herkömmliche Züchtungsmethoden zur Steigerung der Erträge bei vielen Nutzpflanzen mehr oder weniger ausgereizt sind. Forschende weltweit arbeiten zurzeit an verschiedenen Ansätzen, um dieses Ziel zu erreichen.
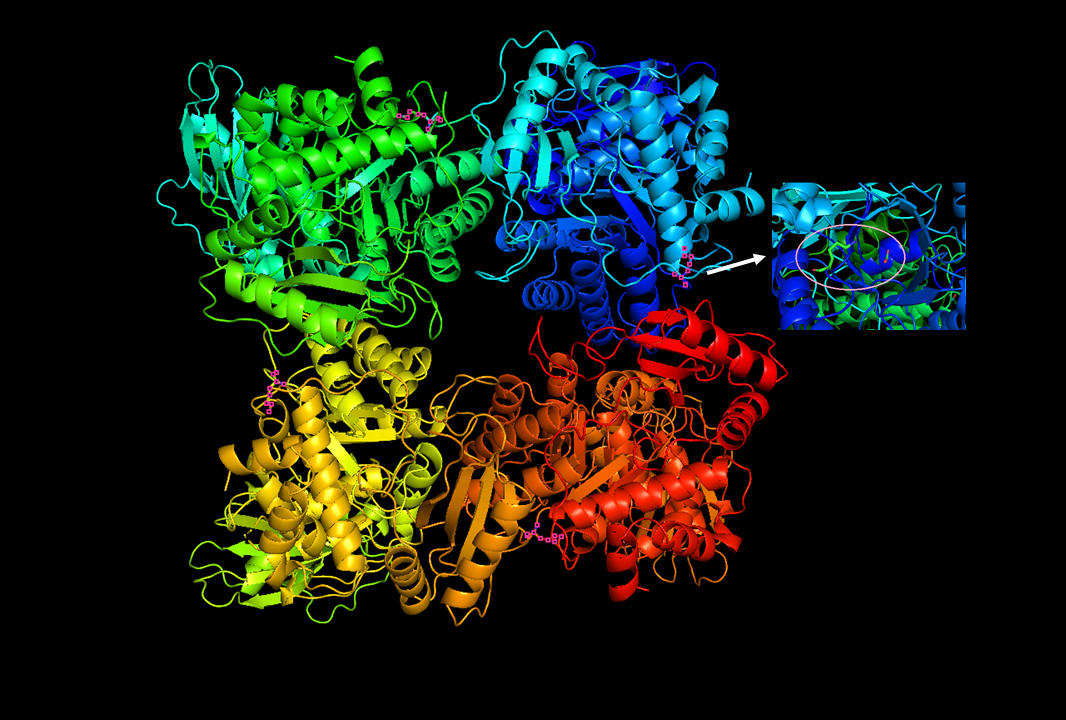
Modell des RuBisCo-Proteins. Es ist das zentrale Protein der Photosynthese. Nur dieses Enzym ist in der Lage, Kohlendioxid (CO2) in die Nahrungskette einzuschleusen.
Bildquelle: © Ericlin1337/Wikimedia.org/CC BY-SA 4.0
Die Entschlüsselung molekularer Puzzles
Auf molekularer Zellebene steht eines der Schlüsselenzyme der Photosynthese, die Ribulose-1,5-bisphosphat-carboxylase/oxygenase (RuBisCo) im Mittelpunkt der Forschung. Die RuBisCo ist das am häufigsten vorkommende Enzym der Erde. Sie fixiert als ersten Schritt des Calvin-Zyklus CO2 aus der Luft, in dessen Verlauf mithilfe der Energie aus der Lichtreaktion der Photosynthese Kohlenhydrate gebildet werden.
Allerdings bindet die RuBisCO als Konkurrenzreaktion auch immer wieder Sauerstoff anstelle von CO2. Passiert dies, werden toxische Nebenprodukte in der Pflanze gebildet, die unter CO2- sowie Energieverbrauch in der sogenannten Photorespiration recycelt werden müssen. Dieser Verlust an Kohlenstoff reduziert die Photosyntheseleistung der Pflanzen erheblich.
Daher gilt die RuBisCo als notorisch ineffizient. Ein Grund ist, dass die RuBisCo ein uraltes Protein ist – entstanden zu einer Zeit, als auf der Erde völlig andere Bedingungen herrschten: mit hohen CO2-Konzentrationen und sehr geringem O2-Gehalt in der Atmosphäre. Das Enzym ist auf die Zusammensetzung dieser längst vergangenen Atmosphäre optimiert und hat sich seitdem evolutionär nicht entscheidend weiterentwickelt. So erklären zumindest manche Wissenschaftler die schlechte Wirksamkeit des Enzyms.
Daher versuchen jetzt verschiedene Forschungsgruppen, RuBisCo so zu verändern, dass es CO2 effektiver als das Original binden kann. Auch andere Strategien zur Abschwächung oder Umgehung der Photorespiration sind in der Entwicklung. Meistens werden hierzu optimierte Enzyme aus anderen Organismen in die Pflanze eingebracht, um die natürliche Photorespiration zu unterbinden. Die toxischen Nebenprodukte sollen im Chloroplasten verbleiben und wieder in den Calvin-Zyklus eingeschleust werden. Zusätzlich werden in Computersimulationen künstliche Stoffwechselwege mit hocheffizienten Enzymen zur Kohlenstoff-Fixierung erprobt. Ein Beispiel hierfür ist der sogenannte CETCH-Zyklus (Crotonyl-CoA/Ethylmalonyl-CoA/Hydroxybutyryl-CoA-Zyklus), der in Zukunft den Calvin-Zyklus ersetzen könnte.
Ein weiterer Optimierungsversuch bezieht sich auf einen zelluläre Abbaukomplex im Cytosol der Pflanzenzelle, dem sogenannten Proteasom. Hier setzen die Forschenden bereits außerhalb der Chloroplasten an, um die Photosyntheserate zu verbessern.
Chloroplasten müssen eine Vielzahl an Proteinen importieren, die nur im Zellkern codiert sind und im Cytosol hergestellt werden. Doch werden ein Teil dieser Proteine nach neusten Erkenntnissen durch das Proteasom bereits wieder abgebaut, bevor sie den Chloroplasten überhaupt erreichen. Im Umkehrschluss steigt die Photosyntheseleistung, wenn das Proteasom in seiner Funktion eingeschränkt wird. Da das Proteasom jedoch auch Proteine abbaut, die nicht im Zusammenhang mit dem Chloroplasten und der Photosynthese stehen, müssen die komplexen Auswirkungen auf den Rest der Pflanzenzelle noch eingehender untersucht werden.
Auch Cyanobakterien bieten interessante Lösungen für eine bessere CO2-Verwertung. Sie enthalten spezielle Organellen, sogenannte Carboxysomen, in denen CO2 angereichert wird. Könnte man Carboxysomen auch in Chloroplasten integrieren, so würde aufgrund des höher konzentrierten CO2 erheblich weniger Sauerstoff von der RuBisCO gebunden werden. Es konnte bereits gezeigt werden, dass sowohl der Import als auch der Zusammenbau carboxysomaler Proteine aus Cyanobakterien in pflanzliche Chloroplasten gelingt. Auch die cyanobakterielle RuBisCO ist in höheren Pflanzen funktionsfähig.
Chloroplasten der Hornmoose, die zu den ältesten Landpflanzen gehören, besitzen ebenfalls die Fähigkeit, CO2 zu konzentrieren. Kürzlich konnte das dafür verantwortliche Gen namens LCIB identifiziert werden. Eine Übertragung dieses Mechanismus in Nutzpflanzen könnte auch hier den Biomasseertrag erheblich steigern.
Blatt ist nicht gleich Blatt
Doch nicht nur auf zellulärer Ebene gibt es zahlreiche Forschungsansätze. Es gibt auch die Idee, den Photosynthese-Typ einiger Kulturpflanzen zu ändern. Die meisten höheren Pflanzen einschließlich unserer Kulturpflanzen wie Weizen, Gerste oder Raps besitzen eine sogenannte C3-Photosynthese. Sie ist die ursprünglichste Form der Photosynthese, bei der der gesamte Photosyntheseprozess – von CO2-Fixierung bis zur Produktion von Zuckern – in einem Zelltyp stattfindet: den Mesophyllzellen der Blätter. Namensgebend für die C3-Photosynthese ist das erste Produkt nach der Fixierung von CO2: das aus drei Kohlenstoffatomen bestehende 3-Phosphoglycerat (3-PGA).
Effizienter arbeitet aber die C4-Photosynthese, die einige Pflanzen als Anpassung an warme und trockene Standorte entwickelt haben. Das Besondere an diesem Photosynthese-Typ: Die Blattarchitektur ist anders und die primäre CO2-Fixierung ist räumlich getrennt von Calvin-Zyklus.
Epidermiszellen eines Blattes: In den in ihnen eingelagerten Chloroplasten läuft die Photosynthese ab.
Bildquelle: © iStock.com/barbol88
In den Mesophyllzellen findet zunächst die CO2-Fixierung statt. CO2 wird hier aber an Phosphoenolpyruvat gebunden und es entsteht dabei das aus vier Kohlenstoff-Atomen bestehende Oxalacetat – daher der Name C4-Photosynthese. Nach Umwandlung in Malat erfolgt der Transport in spezielle Zellen, die kranzförmig um die Leitbündel im inneren des Blattes angeordnet sind – die Bündelscheidenzellen. In diesen Zellen wird das CO2 enzymatisch wieder freigesetzt und über das Enzym RuBisCO in den Calvin-Zyklus eingeschleust.
Der Vorteil dieses Photosynthese-Typs: Die RuBisCO in den Chloroplasten der Bündelscheidenzellen arbeitet in einem nahezu sauerstofffreien Milieu und bei hohen CO2-Konzentrationen. Photorespiration findet hier praktisch nicht statt. Entsprechend höher ist die Effizienz der Photosynthese im Vergleich zum C3-Typ. Nur einige Nutzpflanzen wie Amarant, Hirse, Mais und Zuckerrohr nutzen die C4-Photosynthese.
Basierend auf diesem Wissen bemühen sich Forschungsgruppen weltweit darum, die Stoffwechselprozesse und evolutionären Rahmenbedingungen des Übergangs von C3- zu C4-Pflanzen zu verstehen. So könnten wichtige C3-Nutzpflanzen wie Reis, Weizen oder Kartoffeln in Zukunft durch Züchtung in C4-Pflanzen umgewandelt werden, um ihren Ertrag um bis zu 50 % zu steigern.
Photosynthese allein ist nicht alles
Doch nicht nur die Photosyntheseleistung in den Blättern muss optimiert werden. Nur wenn es zusätzlich gelingt, den entstandenen Zucker auch besser zu transportieren und zu speichern, können Pflanzen letztendlich mehr Biomasse produzieren. Forschende konzentrieren sich daher zunehmend auf einen ganzheitlichen Source-to-Sink-Ansatz (source: Quelle; sink: Abfluss), der sowohl die Photosynthese als auch Transport und Speicherung der Assimilate optimieren will. Dazu ist ein besseres Verständnis des Zusammenspiels von Stoffwechsel- und Entwicklungsprozessen erforderlich. Mithilfe dieser neuen Erkenntnisse könnte vor allem der Ertrag von Wurzel- und Knollenpflanzen wie Kartoffeln oder Maniok gesteigert werden.
Anpassungsfähigkeit gefragt
Die beschriebenen Ansätze zeigen, dass sich auf dem Feld der Photosyntheseforschung einiges bewegt. Doch die im Labor getesteten Ansätze müssen sich auch im Freiland bewähren. Pflanzen sind draußen in ihrer natürlichen Umgebung ständigen Änderungen verschiedener Umweltfaktoren wie Temperatur, Lichtintensität und Wind ausgesetzt.

Über die Autorin:
Annabel Mechela ist Pflanzenwissenschaftlerin und Kommunikatorin mit Leib und Seele. Sie hat einen Bachelor in Kommunikationswissenschaften und Politologie. Nach einem weiterem Bachelor- und Masterstudium mit Fokus auf Molekularbiologie an der LMU München fertigt sie dort gerade ihre Promotion im Bereich Pflanzenbiochemie an. Sie befasst sich dabei mit der Entstehung der Thylakoidmembran, dem Ort der Photosynthese im Inneren der Chloroplasten.
Bildquelle: © privat
Dies erfordert eine konstante Anpassung der Photosynthese. Wie gut und vor allem wie schnell sich Pflanzen auf dem Feld an wechselnde Lichtverhältnisse anpassen können, wirkt sich direkt auf das Ertragspotential aus. Diese Anpassungsfähigkeit kann sich bereits innerhalb einer Art bei verschiedenen Akzessionen stark unterscheiden. Bestrebungen, besonders anpassungsfähige Sorten zu züchten, könnten das Ertragspotenzial um bis zu ein Viertel erhöhen.
Künstliche Blätter
Noch einen Schritt weiter geht die Forschung mit dem Versuch, ein komplett künstliches Blatt herzustellen. Ein elementarer Schritt in der Photosynthese ist die lichtinduzierte Spaltung von Wasser in Wasserstoff und molekularen Sauerstoff mithilfe eines Mangan-Kalzium-Komplexes. Gelänge es, diesen komplexen Prozess mithilfe synthetischer Katalysatoren nachzustellen, könnten kostengünstig Treibstoffe und chemische Grundstoffe als Alternative zu fossilen Ressourcen wie Erdöl, Kohle und Erdgas erzeugt werden.
Derzeit scheitert das Vorhaben noch, da einige molekulare Details der Wasserspaltung nicht restlos entschlüsselt sind. Zudem werden zur künstlichen Wasserspaltung sehr teure und seltene Metalle wie Platin eingesetzt, was eine Großproduktion im Industriemaßstab zu teuer macht. Dieses Dilemma könnte umgangen werden, indem wasserspaltende Mangan-basierte Katalysatoren beispielsweise mit Photovoltaikanlagen kombiniert würden. Anstelle von Strom könnte so kostengünstig und vor allem umweltfreundlich Energieträger und Rohstoffe erzeugt werden.
Die Photosynthese wird noch lange ein Forschungsschwerpunkt der modernen Pflanzenwissenschaft sein. Mit zunehmenden Wissen zu den molekularen Prozessen und Regelungsmechanismen bekommen wir ein immer klareres Bild davon, an welchen Stellschrauben die Photosynthese optimiert werden kann. Schlussendlich wird das Zusammenspiel der verschiedenen Forschungsansätze über den Erfolg der Mission Photosynthese 2.0 entscheiden.
Quellen:
- Acevedo-Siaca, L.G. et al. (2020): Variation in photosynthetic induction between rice accessions and its potential for improving productivity. In: New Phytologist, (online 3. März 2020), doi: 10.1111/nph.16454.
- Blätke, M., Bräutigam, A. (2019): Evolution of C4 photosynthesis predicted by constraint-based modelling. In: eLIFE, (4. Dezember 2019), doi: 10.7554/eLife.49305.
- Cox, N. et al. (2014): Electronic structure of the oxygenevolving complex in photosystem II prior to O-O bond formation. In: Science, (15. August 2014), doi: 10.1126/science.1254910.
- Dogutan, D.K., Nocera, D.G. (2019): Artificial Photosynthesis at Efficiencies Greatly Exceeding That of Natural Photosynthesis. In: Acc Chem Research, Vol. 52(11), (08. Oktober 2019), doi:10.1021/acs.accounts.9b00380.
- Eisenhut, M. et al. (2019): Mechanistic understanding of photorespiration paves the way to a new green revolution. In: New Phytologist, Vol. 223(4), (29. April 2019), doi:10.1111/nph.15872.
- Eisenhut, M., Weber, A.P. (2019). Improving crop yield. In: Science, 363(6422), (04. Januar 2019), doi: 10.1126/science.aav8979.
- Fernie, A.R. et al. (2020): Synchronization of developmental, molecular and metabolic aspects of source–sink interactions. In: Nature Plants 6, (10. Februar 2020), doi: 10.1038/s41477-020-0590-x.
- Gaut, N.J., Adamala, K.P. (2020): Toward artificial photosynthesis. In: Science, 368(6491), (08. Mai 2020), doi:10.1126/science.abc1226.
- Grimmer, J. et al. (2020): Mild proteasomal stress improves photosynthetic performance in Arabidopsis chloroplasts. In: Nature Communications, (3. April 2020), doi: 10.1038/s41467-020-15539-8.
- Gust, D. et al. (2009): Solar fuels via artificial photosynthesis. In: Accounts of Chemical Research, Vol. 42(12), (10. November 2009), doi:10.1021/ar900209b.
- Li, F.-W. et al. (2020): Anthoceros genomes illuminate the origin of land plants and the unique biology of hornworts. In: Nature Plants, (13. März 2020), doi: 10.1038/s41477-020-0618-2.
- Lim et al. (2015): Vibronic origin of long-lived coherence in an artificial molecular light harvester. In: Nature Communications 6: 7755, (9. Juli 2015), doi:10.1038/ncomms8755.
- Lin, M.T. et al. (2014). β-Carboxysomal proteins assemble into highly organized structures in Nicotiana chloroplasts. In: The Plant journal: for cell and molecular biology, (1. August 2014), doi: 10.1111/tpj.12536.
- Lin, M.T. et al. (2014): A faster Rubisco with potential to increase photosynthetis in crops. In: Nature, (17. September 2014), doi: 10.1038/nature13776.
- Maurino, V.G. (2019): Using energy-efficient synthetic biochemical pathways to bypass photorespiration. In: Biochemical Society Transactions, Vol. 47(6), (22. November 2019), doi:10.1042/BST20190322.
- Naseem, M. et al. (2020): Synthetic rewiring of CO2 Sequestration galvanizes plant biomass production. In: Trends in Biotechnology, (17. Januar 2020), doi: 10.1016/j.tibtech.2019.12.019.
- Schwarz, B. et al. (2016): Lichtinduzierte Wasseroxidation durch ein molekulares Manganvanadiumoxid. In: Angewandte Chemie, (9. April 2016), doi: 10.1002/ange.201601799.
- Shen, B. et al. (2019): Engineering a New Chloroplastic Photorespiratory Bypass to Increase Photosynthetic Efficiency and Productivity in Rice. In: Molecular Plant, Vol. 12 (2), (4. Februar 2019), doi.org/10.1016/j.molp.2018.11.013.
- South P.F. et al. (2018): Optimizing photorespiration for improved crop productivity. In: Journal of Integrative Plant Biology, 60(12), (20. August 2018), doi:10.1111/jipb.12709.
- South, P.F. et al. (2019): Synthetic glycolate metabolism pathways stimulate crop growth and productivity in the field. In: Science, 363(6422), (04. Januar 2019), doi: 10.1126/science.aat9077.
- Turan, B. et al. (2016): Upscaling of integrated photoelectrochemical water-splitting devices to large areas. In: Nature Communications 7:12681, (07. September 2016), doi: 10.1038/ncomms12681.
- Walker, B.J. et al. (2016): The Costs of Photorespiration to Food Production Now and in the Future. In: Annual Review of Plant Biology, Vol. 67, (08. Februar 2016), doi:10.1146/annurev-arplant-043015-111709.
- Wang, P. et al. (2017): Re-creation of a Key Step in the Evolutionary Switch from C3 to C4 Leaf Anatomy. In: Current Biology, Volume 27, Issue 21, (6. November 2017), doi: 10.1016/j.cub.2017.09.040.
- Ye, S. et al. (2019): Water Oxidation Catalysts for Artificial Photosynthesis. In: Advanced Materials, Vol. 31(50), (09. September 2019), doi:10.1002/adma.201902069.
- Zhang, B., Sun, L. (2019). Artificial photosynthesis: opportunities and challenges of molecular catalysts. In: Chemical Society Reviews, Vol. 48(7), (21. März 2019), doi: 10.1039/C8CS00897C.
Zum Weiterlesen auf Pflanzenforschung.de:
- Photosynthese optimieren - Neuer CETCH-Zyklus erhöht die Photosyntheserate
- „Super“-Photosynthese - Durchbruch für mehr Nahrungssicherheit?
- Jahrmillionen im Zeitraffer - Evolution der C4-Photosynthese am Computer
- Bypass-OP unter Sonnenschein - 27 % mehr Ertrag durch optimierte Photosynthese
- Scotty, weniger Energie! - Pflanzen mit Defekt im Proteasom bilden mehr Chlorophyll und sparen Energie
- Maniok für Milliarden - Für mehr Ertrag muss man Blatt und Knolle gleichzeitig optimieren
- Wo Licht ist, ist auch Schatten - Natürliche Beleuchtungsunterschiede bremsen Reisertrag
- Von den „Alten“ lernen - Kulturpflanzen könnten mit den Tricks uralter Hornmoose ertragreicher werden
- Der Evolution auf die Sprünge geholfen - Reis auf dem Weg zur C4-Pflanze
Titelbild: Blätter fixieren CO2, um daraus in der Photosynthese Kohlenhydrate herzustellen. (Bildquelle: © Josch13/Pixabay/CC0)