05.08.2005
Forschung Projekte
Erprobung und Weiterentwicklung der Mikroinjektion als neue Transformationsmethode bei Pflanzen
(2001 – 2004) Universität Gießen, Institut für Botanik
Thema
Ziel dieses Projektes war es,
- die Mikroinjektion als Transformationsmethode weiterzuentwickeln, so dass sie auch für pflanzliche Zellen einsetzbar ist;
- und damit ein Verfahren zu etablieren, mit dem die ausschließliche Übertragung funktionell notwendiger Gene ohne Markergene möglich wird.
In Zusammenarbeit mit anderen Teilprojekten des Verbundes sollte die Methode für verschiedene Reporter-Gene und zwei wirtschaftlich interessante Gene angewandt und erprobt werden.
Informationen zum Verfahren:
Zusammenfassung
Es konnten transgene Kalli hergestellt werden. Ohne selektiven Marker konnten allerdings bisher keine transgenen Pflanzen erzeugt werden.
Wenn die DNA wirklich in den Zellkern gelangte, wurde eine sehr hohe Transformationseffizienz erreicht. Dies ist in der Praxis jedoch nicht immer der Fall. Dies kann aber auf einfache Weise überprüft werden.
Versuchsbeschreibung
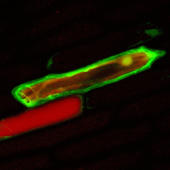
Mit Hilfe feiner Kanülen wurde DNA, die für ein fluoreszierendes Protein codiert, in Zwiebelzellen eingebracht. Zwei Tage nach der Injektion erkennt man den grünen Farbstoff. Die Integration der Fremd-DNA in das Zwiebelgenom war erfolgreich.
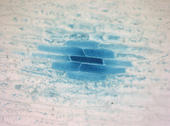
Durch Mikroinjektion wurde DNA in Zwiebelzellen eingeschleust. Das Genprodukt ist durch die blaue Farbe nachweisbar. Nur die Zelle im Zentrum wurde injiziert. Durch kleine Zell-Verbindungskanäle gelangte das Genprodukt auch in die umgebenen Zellen.
Fotos: Michael Knoblauch, Universität Gießen
Als Modellpflanzen zur Erprobung der Mikroinjektion dienten Raps und Kartoffeln. In deren Zellen wurden verschiedene Gene injiziert. Dazu wurde das Verfahren in früheren Versuchen an die Besonderheiten pflanzlicher Zellen angepasst, etwa durch eine speziell geformte Kanüle, die Entwicklung eines Druckgenerators, um den Druckabfall in der Zelle nach dem Einstechen der Kanüle zu verhindern, oder durch eine kontrollierte Abgabe der zu injizierenden Substanz.
Hier sollte die Mikroinjektion als Transformationsmethode für Pflanzenzellen weiter optimiert und erprobt werden. Teilschritte dazu waren:
Erarbeitung von Parametern, welche den Transformationserfolg beeinflussen, etwa: injizierte DNA-Menge, der dazu erforderliche Druck, die Wahl von Zellbestandteilen, die für die Injektion besonders geeignet sind.
Um die Zuverlässigkeit des Verfahrens und die Transformationsrate zu erhöhen, wurden verschiedene Ansätze getestet:
- Versuch einer Agroinjektion: Mikroinjektion in Gegenwart bestimmter Proteineaus Agrobacterium tumefaciens, die am Einbau der T-DNA in das Pflanzengenom beteiligt sind.
- Einsatz spezieller Restriktionsenzyme, die die Integration der DNA unterstützen
- Aktivierung des zelleigenen DNA-Reparatursystems (mit UV-Strahlung) zur Steigerung der Transformationseffizienz
Bei der Mikroinjektion kann auf Markergene verzichtet werden, weil parallel zu der DNA ein Fluoreszenzfarbstoff injiziert wird, der sich über längere Zeit im Zellinneren (Vakuole) hält und so die transformierte Zelle markiert.
Ergebnisse
Bisher wurde DNA in den Zellkern und das Cytoplasma von Kartoffeln injiziert. Zuvor wurden aus speziellem Pflanzengewebe (Abschnitt zwischen zwei Sprossachsen) feinste mikroskopierbare Kartoffelscheiben geschnitten, in denen die Zellkerne gut erreichbar sind.
Es wurden transgene Kalli hergestellt. Ohne selektiven Marker konnten allerdings bisher keine transgenen Pflanzen erzeugt werden.
Es zeigte sich, dass eine sehr hohe Transformationseffizienz vorliegt, wenn die DNA auch wirklich in den Zellkern gelangt. Dies ist in der Praxis jedoch nicht immer der Fall. Der verwendete Fluoreszenzfarbstoff (Texas Red) kann nach Injektion in das Cytoplasma passiv in den Zellkern wandern. Dadurch wird eine Injektion in den Kern vorgetäuscht. Wird die zu injizierende DNA gefärbt, kann dieses Problem jedoch auf einfache Weise umgangen werden.
Thematische Verknüpfungen
Förderung
Bundesministerium für Bildung und Forschung
Förderkennzeichen
0312627 K
Projekt
Originaltitel
Neue Strategien zur Begrenzung der zu übertragenden Gensequenz auf das funktionell notwendige Maß durch Mikroinjektion
Kontakt
Prof. Dr. A.J.E. van Bel
Dr. Michael Knoblauch
Ralf Schindler
Universität Gießen, Institut für Botanik, 35390 Gießen
Veröffentlichungen
Forschungsprojekte
Neue Methoden der Gen-Übertragung 2001-2004
- Gezielter Einbau von Genen, Universität Karlsruhe
- Entwicklung alternativer Marker, SunGene
- Ausschneiden unerwünschter Gene bei der Zuckerrübe, Planta
- Ausschneiden unerwünschter Gene: Cre/lox-System, BBA Braunschweig
- Ausschneiden unerwünschter Gene mit Hilfe eines neuen Rekombinationssystems, Bayr. LA Landwirtschaft, Freising
- Negative Marker, Uni Rostock
- Mikroinjektion bei Pflanzen, Uni Giessen
- Gene für die Mikroinjektion, Bioplant
- Geeignete Pflanzenzellen für die Mikroinjektion, Bioplant
- Mikroinjektion, FI Schmallenberg
- Direkte Veränderungen von Pflanzengenen, BBA Braunschweig
- Sicherheitssystem zur Proteinproduktion mittels pflanzlicher Viren, BBA Braunschweig
- Verbesserte binäre Vektoren, BfZ Siebeldingen
- Markergen-freie Pflanzen durch Auskreuzen, MPIZ Köln
- Transformation bei Plastiden, SunGene
