21.03.2006
Basisinfo
Horizontaler Gentransfer
Nehmen Bakterien Pflanzengene auf?
Bakterien besitzen die Fähigkeit, untereinander direkt Erbmaterial austauschen - sogar über Artgrenzen hinweg. Doch können sie auch Pflanzen-DNA aufnehmen? Wenn das so wäre, könnten Bakterien auch jene Gene nutzen, die neu in gentechnisch veränderte Pflanzen eingeführt worden sind. Doch alle Forschungsprojekte, die sich mit dieser Frage beschäftigten, kommen zu einem übereinstimmenden Ergebnis: Ein solcher horizontaler Gentransfer ist zwar prinzipiell möglich, doch ein extrem seltenes Ereignis.
Bakterien: vielfältig und flexibel
Bei Pflanzen funktioniert die Weitergabe und Durchmischung von Erbmaterial über die Mechanismen der Fortpflanzung, in der Regel zwischen Partnern der gleichen Art. Bakterien können Erbmaterial direkt austauschen, auch über Artgrenzen hinweg. Möglich wird dies durch so genannte „mobile genetische Elemente“ wie z.B. Plasmide. Das sind kleine ringförmige DNA-Elemente, die zusätzlich zum Haupt-Chromosom in der Bakterienzelle vorliegen und sich autonom vermehren können. Die Kopie eines solchen Plasmids kann über direkten Kontakt in eine Empfängerzelle gelangen. Weitere mobile genetische Elemente sind Transposons, „springende Gene“, und Bakteriophagen, Viren, die Bakterien befallen und genetisches Material in ihren Wirt einschleppen.
Mit Hilfe von „mobilen genetischen Elemente“ - hier ein Plasmid, eine kleine vom Hauptchromosom unabhängige DNA-Einheit - können Bakterien sehr leicht und in großem Umfang Erbmaterial austauschen.

Ein Projekt der Sicherheitsforschung hat sich mit der Frage beschäftigt, ob ein Gen, welches eine Herbizidresistenz bewirkt, durch Horizontalen Gentransfer von Rapspollen auf Mikroorganismen des Bienendarms übertragen werden kann. Ein solcher Transfer konnte nicht nachgewiesen werden. Die Wissenschaftler haben zwar herbizidresistente Bakterien gefunden. Solche Resistenzen sind aber natürlicherweise weit verbreitet.
E.coli-Bakterien kommen im Darm von Menschen und Tieren vor. Viele dieser Bakterien besitzen bereits Resistenzen gegen Antibiotika.
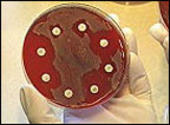
Mit der klassischen Methode werden Bakterien auf Nährböden kultiviert, um Resistenzgene nachzuweisen. Können sie auf Antibiotika-haltigem Nährboden überleben, sind sie resistent. Es ist aber nur ein sehr kleiner Teil der Bakterien kultivierbar. Heute ist es möglich, DNA direkt etwa aus Bodenproben rauszufischen und auf Resistenzgene zu untersuchen.
Im Bild oben werden Plättchen mit verschiedenen Antibiotika in die Zell-Lösung eines bestimmten Bakteriums gelegt. Es entstehen so genannte Hemmhöfe um die Plättchen der Antibiotika, gegen die das Bakterium empfindlich ist.
Bestimmte Bakterien können sogar freie DNA aus ihrer Umgebung aufnehmen. Damit solche DNA ins Bakteriengenom integriert werden kann, braucht es aber z.B. gleichartige Abschnitte, so genannte homologe Sequenzen auf dem Bakterien-Chromosom. Eine solche Art von Gentransfer wird als Transformation bezeichnet und ist bislang nur bei einem sehr geringen Teil der untersuchten Bakterien beobachtet worden.
Transfer von Pflanzen-DNA auf Bakterien
Wenn aber Bakterien freie DNA aufnehmen können, können sie zumindest theoretisch auch Pflanzen-DNA aufnehmen. Also wurde in solchen Bereichen untersucht, wo es denkbar wäre, dass Fremdgene aus transgenen Pflanzen sich verbreiten könnten, wenn sie mit Bakterien zusammentreffen, etwa im Wurzelraum von Pflanzen oder im Darm von Tieren. Alle diese Untersuchungen haben ergeben, dass es keine unüberwindlichen Barrieren für Horizontalen Gentransfer zwischen Bakterien gibt. Ein Transfer von Pflanzen-DNA auf Bakterien konnte dagegen unter natürlichen Bedingungen nicht nachgewiesen werden.
Was muss passieren, damit so ein Gentransfer von der Pflanze in ein Bakterium überhaupt stattfinden kann?
- Das Fremdgen muss intakt aus einer abgestorbenen Pflanzenzelle entlassen werden.
- Es muss im bakteriellen Lebensraum überdauern. Häufig wird die DNA schnell abgebaut und liegt nur bruchstückhaft vor.
- Dieses Gen muss dann mit einer DNA-aufnahmefähigen „kompetenten“ Bakterienzelle zusammentreffen und in die Zelle gelangen.
- Und schließlich muss es dann ins Bakteriengenom integriert werden, damit es überhaupt wirksam werden kann, d.h. abgelesen und in ein Protein umgesetzt werden kann. Das aber ist äußerst unwahrscheinlich, in aller Regel wird die Fremd-DNA in den Bakterien degradiert, d.h. weiter abgebaut.
Im Labor: Transfer provoziert
In zwei Projekten der Sicherheitsforschung konnte bisher Horizontaler Gentransfer unter „optimierten Laborbedingungen“ nachgewiesen werden. Im Labor sind Bakteriendichte und Klimabedingungen einstellbar, es kann isolierte Pflanzen-DNA verwendet werden und es können gezielt aufnahmefähige Bakterien eingesetzt werden.
In diesen beiden Projekten wurde ein Bakterienstamm zusätzlich so präpariert, das ein Horizontaler Gentransfer geradezu provoziert wurde: In die Bakterien wurde ein unvollständiges Gen für eine Kanamycin-Resistenz eingeführt. Zur Reparatur dieses Gens benötigten sie einen bestimmten Genabschnitt aus den transgenen Pflanzen. Diese enthielten nämlich das vollständige Kanamycin-Resistenz-Gen als Markergen. Weil in Pflanze und Bakterium gleiche DNA-Sequenzen vorlagen, konnten die Bakterien das unvollständige Resistenzgen relativ einfach über die Aufnahme transgener Pflanzen-DNA vervollständigen. Dennoch war die Transfer-Rate äußerst gering. Bei einem der Projekte mit transgenen Zuckerrüben gab es einen Transfer bezogen auf 5,36 Milliarden Bakterien.
Risiko Antibiotikaresistenz-Gene?
Wenn über das Risiko der Verbreitung von Transgenen über Horizontalen Gentransfer gestritten wird, dann geht es insbesondere um Antibiotikaresistenz-Gene. Diese Gene werden als Markergene eingesetzt, um diejenigen Pflanzen herauszufischen, bei denen eine gentechnische Transformation geglückt ist. Erfolgreich transformierte Pflanzen sind in der Lage auf Antibiotika-haltigem Nährboden zu wachsen.
Krankheitserregende Bakterien, die gegen ein oder mehrere Antibiotika resistent sind, werden zunehmend zum Problem. Die Befürchtung ist, dass Antibiotikaresistenz-Gene aus transgenen Pflanzen wieder zurück in Bakterien gelangen könnten. So könnten sie etwa im Darm nach Verzehr von transgenem Pflanzenmaterial auf Darmbakterien übertragen werden und damit den Einsatz von Antibiotika im Krankheitsfall unwirksam machen.
Nach dem heutigen Stand der Wissenschaft gibt es eine Reihe plausibler Argumente, die eine solche Befürchtung relativieren:
- Ein Transfer von Pflanzen-DNA in Mikroorganismen ist theoretisch denkbar, aber äußerst unwahrscheinlich.
- Antibiotikaresistenz-Gene stammen aus Bakterien und sind ohnehin weit verbreitet. Im menschlichen Darm etwa sind durchschnittlich 27 Prozent aller E.coli-Bakterien resistent gegenüber Ampicillin. Es ist viel wahrscheinlicher, dass solche Resistenzen im direkten Transfer zwischen Bakterien ausgetauscht werden, als dass sie über den „Umweg“ transgene Pflanze übernommen werden.
- Ein möglicher Horizontaler Gentransfer von transgenen Pflanzen auf Bakterien trägt zur Verbreitung der Resistenzgene wenn überhaupt nur unwesentlich bei. Das eigentliche Problem liegt woanders, nämlich in der extensiven Anwendung von Antibiotika in der Human- und Tiermedizin, aber auch in der Tierhaltung. Antibiotika wurden insbesondere bei Schweinen standardmäßig dem Futter zugesetzt, um das Wachstum anzuregen. In Schweinegülle ist folglich der Selektionsdruck auf die Bakterien sehr hoch, d.h. Antibiotikaresistenzen verbreiten sich, weil sie den Bakterien einen Überlebensvorteil bringen.
- Wie solche Transfer-Vorgänge funktionieren, darüber weiß man heute viel mehr als noch vor ein paar Jahren. Antibiotikaresistenz-Gene befinden sich meist auf mobilen genetischen Elementen. Mit Hilfe spezieller Methoden können diese Elemente nachgewiesen und charakterisiert werden, sogar solche, die selber kein Resistenzgen tragen, aber Gene zwischen Bakterien transportieren. Wenn sich in einer Umweltprobe solche „Überträger“ befinden oder auch Plasmide mit extrem breitem Wirtsbereich, die Resistenzen gegen mehrere Antibotika vermitteln, dann deutet das auf einen hohen Selektionsdruck hin. Wissenschaftler der Biologischen Bundesanstalt (BBA) (seit 2008 Julius Kühn-Institut (JKI)), Braunschweig haben im Rahmen eines EU-Projektes erstmalig nachweisen können, dass in begülltem Boden in hohem Maße solche „genmobilisierende Aktivität“ stattfindet, in unbegülltem dagegen nicht.
Mehr bei bioSicherheit
Thematische Verknüpfungen
Streitfall Markergene

Im Web
Informationen zu Antibiotikaresistenz- Markergenen:
- EFSA: Europäische Behörde für Lebensmittelsicherheit
- EFSA: Gutachten zu Antibiotikaresistenz-Genen gv-Pflanzen 2004 (Zusammenfassung, deutsch)
- EFSA bewertet Antibiotikaresistenz-Markergene in gentechnisch veränderten Pflanzen (11.06.2009)
- Stellungnahme der Zentralen Kommission für die Biologische Sicherheit (ZKBS) für die Sicherheitsbewertung von Antibiotika-Resistenzgenen im Genom gentechnisch veränderter Pflanzen, Kurzfassung (Dez. 2008)
- Zentrale Kommission für biologische Sicherheit (ZKBS)
- EU-Freisetzungs-Richtlinie (2001/18/EG)
