14.02.2006
Basisinfo
Verfahren des Gentransfers
Mikroinjektion: Gene mit der Spritze
Was bei tierischen Zellen und im medizinischen Bereich schon fast Routine ist, bereitete bei Pflanzenzellen bislang große Schwierigkeiten: Das direkte Einschleusen neuer Gene mit Hilfe feinster Kanülen. Dabei wäre die Mikroinjektion eine elegante Methode, auf Markergene zu verzichten.
Bei der Mikroinjektion wird DNA über eine eingeführte Kanüle direkt in die Zelle oder sogar den Zellkern gespritzt. Der Vorgang wird unter dem Mikroskop beobachtet und gesteuert. Anschließend integriert sich die DNA - vermutlich im Rahmen von zelleigenen DNA-Reparaturprozessen - in das Genom der Pflanze.

Mikroinjektion in die Zelle eines Kartoffelkallus.
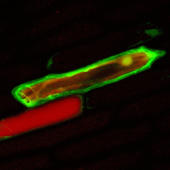
Mit Hilfe feiner Kanülen wurde DNA, die für ein fluoreszierendes Protein codiert, in Zwiebelzellen eingebracht. Zwei Tage nach der Injektion erkennt man den grünen Farbstoff. Die Integration der Fremd-DNA in das Zwiebelgenom war erfolgreich.
Fotos: Michael Knoblauch, Universität Gießen
Der Vorteil der Mikroinjektion ist, dass bei dieser Methode der gentechnischen Veränderung von Pflanzen theoretisch keine Markergenemehr erforderlich sind.
- Das Zielgen - das eine neue Eigenschaft vermittelt - wird direkt in eine einzelne Zelle eingeführt.
- Die so transformierten Zellen sind leicht zu erkennen, wenn mit der DNA ein Farbstoff durch die Kanülen eingespritzt wird (siehe Foto).
- Wenn das Verfahren funktioniert, ist eine Selektion der transformierten Zellen mit Hilfe von Antibiotikaresistenz- oder Herbizidresistenz-Markern ist nicht mehr erforderlich.
Bisher wird diese Methode vor allem bei tierischen Zellen angewandt. Von diesen unterscheiden sich pflanzliche Zellen unter anderem dadurch, dass sie eine stabile Zellwand besitzen. Um die Mikroinjektion auch bei Pflanzen einzusetzen, muss das Verfahren an deren Besonderheiten angepasst werden.
- Der wichtigste Unterschied ist die Zellwand und der in pflanzlichen Zellen vorherrschende Innendruck von bis zu 30 bar. Wird mit einer üblichen, für tierische Zellen geeigneten Kanüle in eine Pflanzenzelle eingestochen, kommt es zu drastischen Druckverlusten. Die Zelle stirbt ab. Um das Problem zu lösen, werden noch dünnere Kanülenspitzen entwickelt und in Kombination mit einem sensitiv regulierbaren Druckgenerator eingesetzt. Auf diese Weise dringt die Kanüle in die Pflanzenzelle ein, ohne diese zu zerstören.
- Ein weiterer Ansatz, um die Mikroinjektion als Transformationsmethode bei Pflanzenzellen zu verbessern, zielt auf die Effizienz, mit der die eingespritzten Gene in das Pflanzengenom integriert werden. Eine Möglichkeit besteht darin, zusammen mit den zu übertragenden Gen-Sequenzen spezielle Proteine zu injizieren, welche den stabilen Einbau „fremder“ Gene in Pflanzengenome unterstützen und vom Agrobacterium tumefaciens gebildet werden (Agroinjektion). Dieses Bodenbakterium ist natürlicherweise in der Lage, eigene Gene in das Genom von Pflanzen einzuschleusen.
Ergebnisse: Mehrere Projekte der Sicherheitsforschung haben sich mit der Mikroinjektion bei Pflanzen beschäftigt. Es gelang, sie als neue Transformationsmethode zu etablieren.
Allerdings konnte nicht in allen Fällen eine hohe Transformationseffizienz erreicht werden. Zudem konnten transgene Pflanzenzellen nach einer Mikroinjektion nur dann zu Pflanzen regeneriert werden, wenn ein Markergen (Kanamycin-Resistenz) eingeführt worden war. Auch bei der Mikroinjektion kann vorerst auf Markergene nicht verzichtet werden.
Dagegen ist die Agroinjektion nicht erforderlich, um transgene Pflanzen über Mikroinjektion zu erzeugen. Das eröffnet grundsätzlich die Möglichkeit, dieses Verfahren ohne großen Aufwand auch kommerziell zu nutzen.
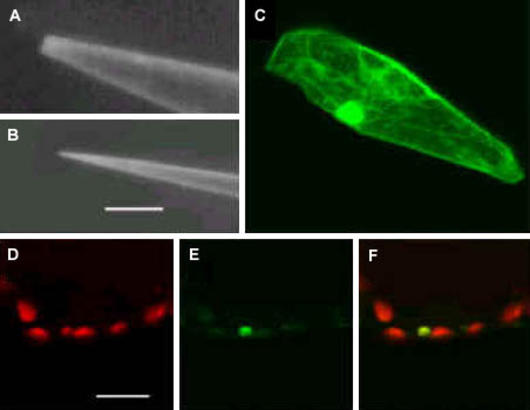
Mikroinjektion bei Pflanzenzellen. (A, B) Rasterelektronische Aufnahme konventioneller (A) und der neu entwickelten Glaspipette (B). (C) Fluoreszierendes Protein nach Injektion in den Kern einer Pflanzenzelle. (D-F) Injektion in Chloroplasten (Organellen in Pflanzellen); Darstellung der Chlorophyll- (D) und GFP- Fluoreszenz (E) sowie deren Überlagerung (F).
Thematische Verknüpfungen
Streitfall Markergene

