13.06.2007
Forschung Live
SiFo-Projekt: Erzeugung Markergen-freier Reben durch Nutzung des Cre/lox-Systems
Wein-Forschung: Langwierige Prozesse
Ein heller Neubau, ein Gewächshaus unterm Dach und Weinreben bis zum Horizont - die Forscher am AlPlanta Institut für Pflanzenforschung in Neustadt an der Weinstraße sind um ihren Arbeitsplatz zu beneiden. Wo andere auf graue Parkplätze und Häuserschluchten blicken, haben sie freie Sicht ins Grüne, ihr Forschungsobjekt immer vor Augen. Schwerpunkt der Abteilung Reben-Biotechnologie sind praktische Fragestellungen im Weinbau, etwa die Entwicklung von virus- und pilzresistenten Rebsorten. Wo die klassische Züchtung nicht weiterkommt, entwickeln und verwenden die Wissenschaftler gentechnische Methoden, die im Rahmen der biologischen Sicherheitsforschung optimiert werden.

Dr. Goetz Reustle, Leiter der Abteilung Reben-Biotechnologie am AlPlanta Institut für Pflanzenforschung, zeigt die verschiedenen Schritte auf dem langen Weg vom Kallus bis zur gentechnisch veränderten Weinrebe

Aus „Einaugen-stecklingen“ der Weinrebe treiben Blätter und Blüten. Aus den Staubgefäßen züchten die Forscher embryogenen Kallus.
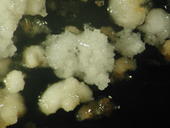
Durch unorganisiertes Wachstum hat sich aus den Staubbeuteln ein Zellkomplex gebildet. Durch Zugabe von Phytohormonen können daraus komplette Weinpflanzen herangezogen werden. Agrobakterien übertragen die gewünschten Gene in die Pflanzenzellen.

Auf Antibiotika-haltigem Medium wachsen nur Pflanzen, die ein Gen für Antibiotikaresistenz als Marker enthalten, bei denen also die Transformation erfolgreich war.

Eine Mitarbeiterin setzt die Weinreben unter sterilen Bedingungen auf ein neues Nährmedium.

Wein im Reagenzglas: Im Cre/lox-Projekt entwickeln die Wissenschaftler eine Methode, mit der das Gen für Antibiotika-Resistewnz (nptII-Gen) wieder aus den Pflanzen entfernt werden kann.

Experiment gelungen? Ein Reportergen (Green Fluorescent Protein, GFP) lässt die Blätter unter UV-Licht neongrün leuchten, wenn das Markergen entfernt wurde.

Bei idealen Temperatur- und Lichtverhältnissen in der Klimakammer entwickeln sich die transgenen Weinreben besonders gut.

Gentechnisch veränderte Weinreben im Gewächshaus
Die Führung durch die hochmodernen Labors endet im Keller des Instituts. Wer hier allerdings ein süffiges Schlückchen erwartet wird enttäuscht – und sogleich entschädigt mit einem Blick durchs Mikroskop. Licht aus, Spot an: unter UV-Licht fluoresziert das zarte Blatt eines Weinpflänzchens neongrün. „Es hat funktioniert“, kommentiert Goetz Reustle, Leiter der Abteilung Reben-Biotechnologie. Er meint damit die Methode, die das Institut anwendet, um Antibiotikaresistenz-Gene aus gentechnisch veränderten Pflanzen zu entfernen. Diese werden oft als „Marker“ an das Gen gekoppelt, das in die Pflanze übertragen werden soll. Sie zeigen an, ob die gentechnische Veränderung stattgefunden hat: nur etwa fünf von tausend Zellen nehmen die neuen Gene tatsächlich auf und überleben dann die Behandlung mit Antibiotika. Die meisten eingesetzten Markergene beziehen sich auf Antibiotika, die in der Human- und Tiermedizin keine große Rolle mehr spielen. Trotzdem sorgt das technische Hilfsmittel in der öffentlichen Diskussion für Zündstoff: Es besteht die Befürchtung, die Anti-biotikaresistenz könnte beim Anbau gentechnisch veränderter Pflanzen durch einen Gentransfer auf krankheitserregende Bakterien übertragen werden. Auch wenn ein solcher Gentransfer von der Pflanze auf ein Bakterium höchst unwahrscheinlich ist und unter natürlichen Bedingungen bislang nicht nachgewiesen werden konnte, beschäftigt sich die biologische Sicherheitsforschung vorsorglich mit Methoden die geeignet sind, das Markergen aus dem Pflanzengenom herauszuschneiden.
Das Cre/lox-Rekombinationssystem nutzt hierfür das Enzym „Cre-Rekombinase“. Es erkennt das zu entfernende Markergen anhand von zwei flankierenden Erkennungssequenzen, den „lox-Sites“, die bei der Transformation zusätzlich in die Pflanzen eingebracht wurden. Das Enzym gelangt in die jungen transgenen Pflanzen, indem sie mit einem Virus infiziert werden, der das Cre-Rekombinase-Gen besitzt. Cre-Rekombinase wird so vorübergehend in den Pflänzchen gebildet.
Um festzustellen, ob die Methode tatsächlich geklappt hat und das Markergen herausgeschnitten wurde, nutzen die Forscher einen Trick: Außerhalb der lox-Sites haben sie ein Reportergen eingebaut, das für die Bildung von grün fluoreszierendem Protein (gfp) verantwortlich ist. Das Protein wird allerdings erst gebildet, wenn das Markergen entfernt wurde und das Reportergen somit direkt an einen Promotor anschließt – eine DNA-Sequenz, die als „Genschalter“ dessen Ablesung ermöglicht. „Durch die Rekombination, also die Umorganisation der DNA wird das gfp-Gen akti-viert und die Markergen-Entfernung als grüne Fluoreszenz sichtbar gemacht“, erklärt Reustle.
Vom Zellhaufen zum transgenen Spross
Sein Ziel: Die Methode, die an Tabak bereits erfolgreich war, soll im Rahmen der biologischen Sicherheitsforschung auf Weinreben übertragen werden. Aufgrund ihrer Langlebigkeit haben diese einen besonders nachhaltigen Einfluss auf die Umwelt. Doch dem Erfolg geht ein langwieriger Prozess voraus, der den Wissenschaftlern viel Geduld abverlangt. Reustle erklärt warum. Auf der Laborbank vor ihm stehen Petrischalen und Reagenzgläser mit Weinpflänzchen in verschiedenen Größen und Entwicklungsstufen. Als Rohstoff für die Transformation dient embryogener Kallus: ein milchig-weißer Zellkomplex, erzeugt aus den Staubbeuteln von Weinblüten. Ist nach etwa einem halben Jahr Aufzucht und Pflege ausreichend Kallusmaterial vorhanden, werden im nächsten Schritt Agrobakterien als Vehikel benutzt, um die gewünschten Gene zu übertragen. „Und dann beginnt die Mühsal der Selektion“, sagt Reustle und deutet auf eine Petrischale. Aus den Zellhaufen wachsen nach Zugabe von pflanzlichen Hormonen winzige Sprosse, die nur dann ein Umsetzen auf Antibiotika-haltiges Nährmedium überleben, wenn sie das lox-Genkonstrukt samt Markergen in ihr Genom integriert haben. Was hier wächst wird von nun an in Klimakammern und im Gewächshaus liebevoll gepäppelt. Wie viele der Pflänzchen es am Ende schaffen, ist dennoch ungewiss: durch den Stress geht die Regenerationsfähigkeit nicht selten verloren. „Wir schleusen Massen an Material durch. Manchmal entsteht daraus viel, manchmal gar nichts. Mit viel Glück haben wir nach einem Jahr zehn transformierte Weinpflanzen“, erläutert Reustle.
Modellpflanze Tabak
Das System sei wenig effizient, jedes Labor müsse die Methode selbst optimieren, so Reustle. Ein langwieriges Unterfangen bleibt es trotzdem. „Wenn wir Pech haben, dauert es fünf bis zehn Jahre, bis wir Erfolg im wissenschaftlichen Sinne haben“, bedauert der Forscher und blickt auf die Tabakpflanzen, die zwischen all den Weinpflänzchen auf der Laborbank stehen. Tabak wird in der Biotechnologie häufig als Modellpflanze verwendet, um neue Verfahren zu erproben. Der Vorteil: Er lässt sich leicht transformieren und zu transgenen Pflanzen regenerieren, hat eine kurze Generationszeit und ist von handlicher Größe. „Proof of Concept“ nennen das die Wissenschaftler. „Mit Tabak kann man viele tolle Dinge machen“ sagt Reustle. Die angewandte Forschung an Wein sei da ungleich schwieriger.
Reife Entwicklungen
Hinzu kommt, dass sich die Forscher auf vier im Weinbau etablierte Rebsorten beschränken – und was bei der einen Sorte funktioniert, klappt bei der anderen noch lange nicht. Man fühle sich den Pflanzguterzeugern verpflichtet, mit deren Unterstützung der Forschungsschwerpunkt Reben-Biotechnologie vor Jahren entstanden ist, so Reustle. Langfristig soll das Cre/lox-System mit wirtschaftlich relevanten Genen verknüpft werden, zum Beispiel einer Virus- oder Pilzresistenz. Aus Sicht des Forschers wäre Letzteres durchaus eine Chance, Pflanzenschutzmittel einzusparen, die im Weinbau in großen Mengen eingesetzt werden. Selbst Öko-Winzer suchen nach verlässlichen Konzepten gegen die gefürchteten Pilze und behelfen sich mit Kupferpräparaten, welche als Schwermetalle die Böden belasten. Dass gentechnisch veränderter Wein in naher Zukunft auf den Markt kommt, glaubt Reustle trotzdem nicht. Wein sei eben ein „sehr emotionales Produkt“, ein Genussmittel. „Möglicherweise werden wir noch ein paar Jahre forschen, ohne dass jemand an unserer Arbeit interessiert ist. Vielleicht ist das, was wir heute machen, erst in zwanzig Jahren interessant und dann sind wir froh, wenn wir diese Vorleistung erbracht haben. Sei es methodisch oder mit einem Produkt“, ist der Wissenschaftler überzeugt. Gerade in langjährigen Kulturen müsse man so denken.
Thematische Verknüpfungen
Themen
Im Web
Wein-Forschung

Goetz Reustle vom AlPlanta Institut für Pflanzen- forschung in Neustadt a.d. Weinstraße über Gentechnik in der Rebenzüchtung und das „emotionale Produkt“ Wein.
