RNA Live-Tracking mit CRISPR/Cas
Forscher nutzen CRISPR/Cas-Komplex als „GPS-Sender“ für RNA
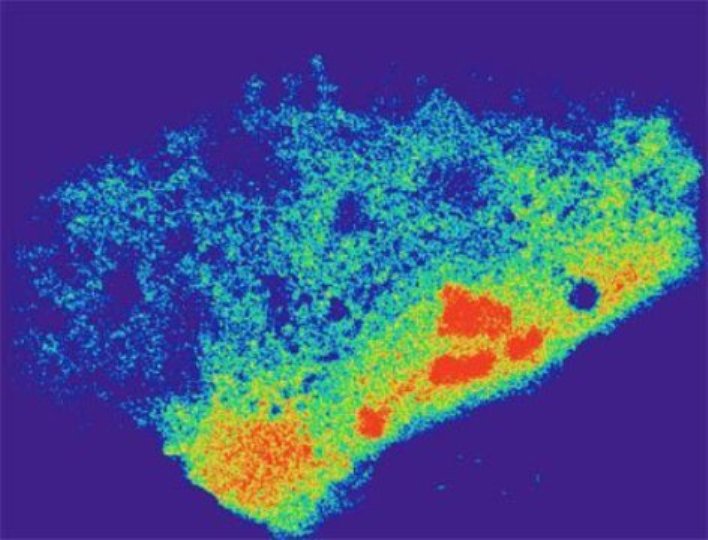
mRNA Verteilung im Cytoplasma einer lebenden menschlichen Zelle unter Stress. (Bildquelle: © UC San Diego Health)
Mit Hilfe kleiner Modifikationen am CRISPR/Cas Komplex gelingt es Forschern erstmals, die Technologie zur Überwachung und Lokalisierung von mRNA zu nutzen. Ein wichtiger Schritt bei der Erweiterung des Anwendungsspektrums über die Genomeditierung hinaus in Richtung Transkriptomeditierung.
Man muss nicht zwingend zum Kreis der Genetiker gehören, um schon einmal etwas zum Thema CRISPR/Cas gehört, gelesen oder gesehen zu haben. Längst hat das Akronym den Dunstkreis der Fachwelt verlassen und den Weg in die Massenmedien gefunden. Die Rede ist von jenem bakteriellen RNA-Proteinkomplex, oft „Genschere“ genannt, mit dem DNA einfach, punktgenau und äußerst effizient geschnitten und verändert werden kann.
Eine andauernde Revolution
Eine Revolution, die in den späten Neunzigern begonnen hatte und 2014 mit der ersten Veröffentlichung zur Nutzung von CRISPR/Cas9 stark an Dynamik gewonnen hat. Unter der Leitung von Jennifer Doudna, Mitstreiterin der ersten Stunde, gelang es einem Forscherteam, den Anwendungsbereich erneut zu erweitern und einen weiteren Meilenstein zu setzen. Erstmals, erklärt Doudnas Kollege Gene Yeo, habe es geklappt, die Technologie erfolgreich zur Überwachung und Verfolgung von Messenger-RNA einzusetzen, ihre Wege und Bewegungsmuster in lebendigen Zellen detailliert zu verfolgen und abzubilden.
Dank seiner Präzision wird das CRISPR/Cas-System als "genetische Chirurgie" oder Genomeditierung der dritten Generation bezeichnet. Im vorliegenden Fall wurde die Schere jedoch deaktiviert, der Komplex als Peilsender eingesetzt.
Bildquelle: © iStock.com/wildpixel
Alte Grenzen überschreiten
Bereits existierende Konzepte stoßen hier häufig an Grenzen. Unter anderem, weil sie nicht spezifisch genug eingesetzt werden können oder für bildgebende Verfahren ungeeignet sind. Im Unterschied zur Genomeditierung wird die CRISPR/Cas Technologie nun nicht mehr eingesetzt, um möglichst gezielte Schnitte zu setzen oder Veränderungen vorzunehmen, sondern wegen ihrer Fähigkeit, zielsicher zu einem genetischen Zielort zu navigieren und dort anzudocken.
Mit dem Peilsender durch das Cytoplasma
Mit kleinen Modifikationen am Cas9-Enzym ist es möglich, die „Genschere“ zu deaktivieren und nicht mehr wie bisher DNA-Sequenzen, sondern RNA-Fragmente anzusteuern und dort anzudocken. Als Anker dient eine kurze Sequenz von Nukleinsäuren (PAMmer), die komplementär zur transkribierten PAM-Sequenz im avisierten RNA-Fragment erstellt wird. Um das Zielobjekt bei seiner Reise durch das Cytoplasma nach erfolgreichem Andocken bzw. der Hybridisierung nicht mehr aus den Augen zu verlieren, wird dem Komplex eine Art leuchtender Peilsender in Form eines fluoreszierenden Proteins verpasst.
RNA unter Stress
Auf dieser Weise gelang es den Forschern im Zuge von Tests an menschlichen lebenden Zellen, die Bewegung und Verteilung von mRNA-Molekülen für die Proteinsynthese – in diesem Fall ACTB, TFRC und CCNA2 – unter Stress zu beobachten (siehe Titelbild). Die Forscher sehen darin die Grundlage für die Modifikation bzw. Editierung des Transkriptoms.
Bis solche Eingriffe jedoch möglich sein werden, sei es aber noch ein weiter Weg, erklärt Yeo: „In der nächsten Phase geht es darum, weitere Messverfahren und -ansätze zu entwickeln, um neben der einfachen Bewegung und Ortsbestimmung zusätzliche Parameter zu definieren und zu erfassen.“
Großes Potenzial für die Medizin
Er und seine Kollegen sind zuversichtlich: „Wir befinden uns noch ganz am Anfang, das Potenzial der CRISPR Technologie für die Genomeditierung in der Medizin vollends zu erfassen und zu nutzen. Doch wir wissen auch, dass viele Krankheiten eng mit Problemen und Fehlern im Zusammenhang mit der RNA verbunden sind. Genau dort können wir nun ansetzen, mehr über die Ursachen und Krankheitsbilder erfahren, Therapien begleiten oder die Entwicklung neuer Medikamente unterstützen.“
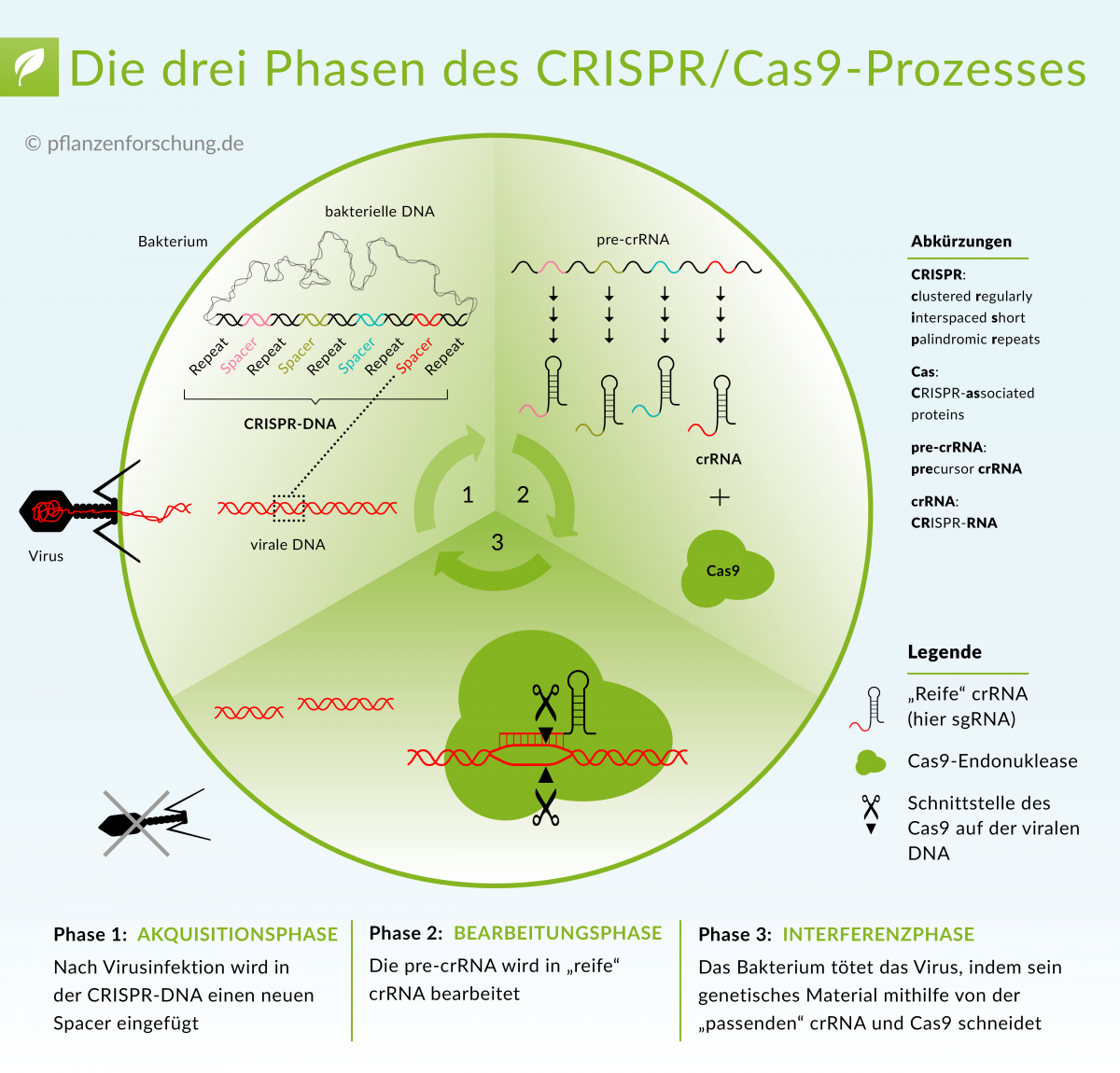
CRISP/Cas 9: Lesen Sie mehr darüber, wie diese neue Technologie auf molekularer Ebene funktioniert: "Wie CRISPR/Cas funktioniert"
Zu den entsprechenden Krankheiten gehören u. a. verschiedene Krebsarten, neurodegenerative Krankheiten wie die Amyotrophe Lateralsklerose (ALS) oder Entwicklungsstörungen des Nervensystems, z. B. das Fragile-X-Syndrom. Wie die Technologie dort eingesetzt werden könnte, erklärt Erstautor David Nelles: „Denkbar ist, den RNA-Transport innerhalb erkrankter Nervenzellen über einen längeren Zeitraum zu überwachen, um krankheitsbildende Faktoren, Prozesse oder Mechanismen zu identifizieren und dadurch neue Ansatzpunkte für Therapien zu erkennen.“
Während die Studie vorrangig auf das Potenzial für die Medizin verweist, dürfte auch in der Pflanzenforschung die Möglichkeit begrüßt werden, RNA-Aktivitäten mittels CRISPR/Cas in Zukunft besser überwachen zu können.
Der Debatte ein Schritt voraus
Zu einem Zeitpunkt, in dem die öffentliche Debatte zum Umgang mit der CRISPR Technologie gerade an Fahrt gewinnt, sieht es ganz danach aus, als sei die Wissenschaft im Begriff, den Schauplatz der Debatte zu erweitern oder sogar zu verlassen. Während Befürworter und Gegner über die Frage diskutieren, ob CRISPR/CAS9 Gentechnik sei oder nicht, wie diese wissenschaftlich, ethisch, juristisch, ökonomisch und politisch bewertet werden solle, entwickeln die Vorreiter konkrete Ideen zur Editierung des Transkriptoms.
Dort würde es nicht mehr um Veränderungen am „Bauplan des Lebens“ gehen, wie es häufig pathetisch heißt, sondern darum, Genprodukte gezielt zu verändern. Und das nicht mehr für die Ewigkeit, sondern theoretisch zeitlich befristet, z.B. zur Bekämpfung von Krankheiten oder zur Anpassung von Nutzpflanzen an veränderte Umweltbedingungen.
Quellen:
- Nelles, D. et al. (2016): Programmable RNA Tracking in Live Cells with CRISPR/Cas9. In: Cell, Vol. 165 (1-9), (7. April 2016), http://dx.doi.org/10.1016/j.cell.2016.02.054
- Cahrpentier, E., Heckl, D. (2016): Toward Whole-Transcriptome Editing with CRISPR/Cas9. In: Molecular Cell, Vol. 58 (4), http://dx.doi.org/10.1016/j.molcel.2015.05.016
Weiterlesen auf Pflanzenforschung.de:
- Passgenaues Immunsystem in Pflanzen
- Gibt es neben Chancen auch Risiken von CRISPR/Cas9?
- Wie CRISPR/Cas funktioniert
Titelbild: mRNA Verteilung im Cytoplasma einer lebenden menschlichen Zelle unter Stress. (Bildquelle: © UC San Diego Health)
