Zwölf auf einen Streich
Mit Mulitplex-Editierung bis zu zwölf Gene zeitgleich ausgeschaltet
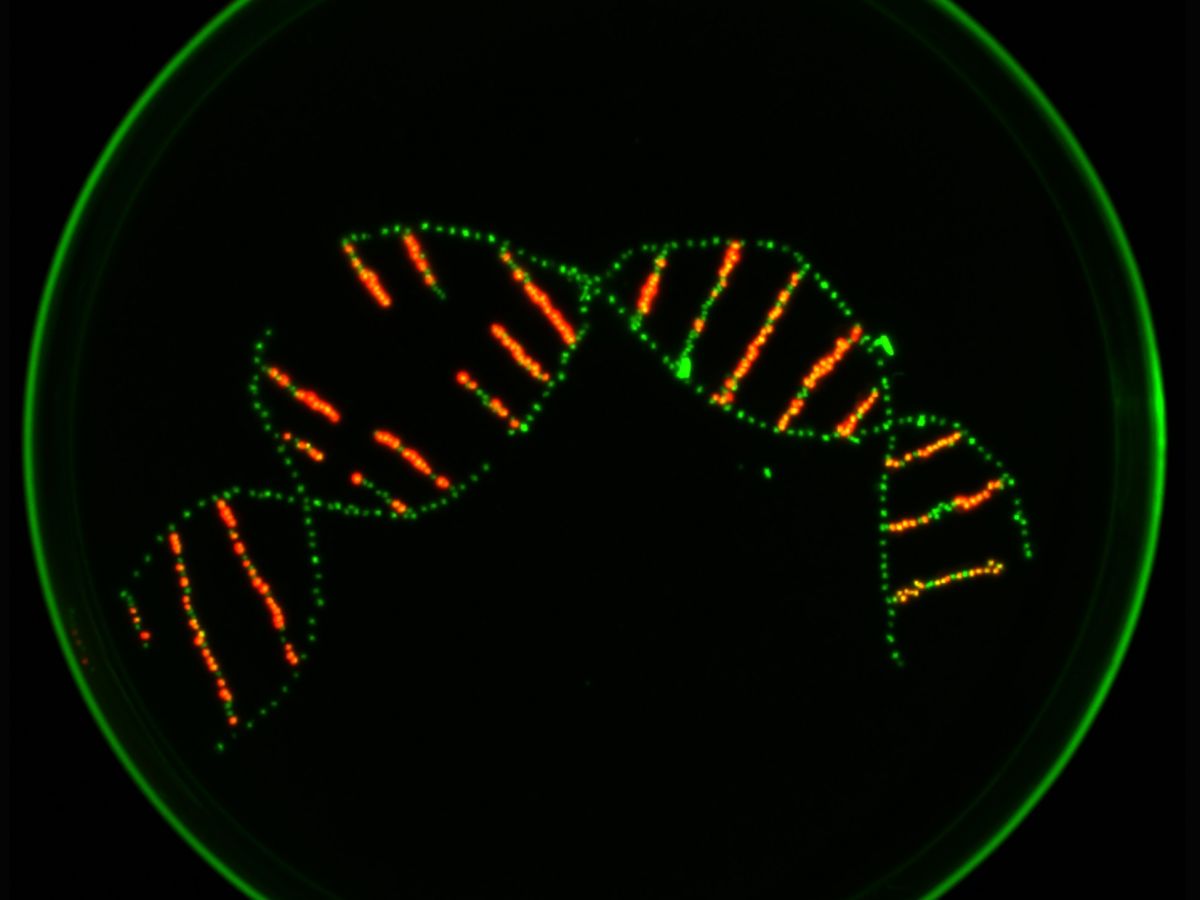
Mithilfe von Markern sortierte das Team die Pflanzen aus, bei denen die Genschere ihre Arbeit erfolgreich verrichtet hatte. Unter UV-Licht erscheinen die Samen farbig - je nachdem welche Marker sie in sich tragen. (Bildquelle: © Jessica Lee Erickson)
Einem deutschen Forschungsteam ist es gelungen, die Genschere CRISPR/Cas9 so zu optimieren, dass sie gleichzeitig an mehreren Stellen im Genom tätig wird.
Die Genomeditierung – und speziell CRISPR/Cas9 – ist aus dem Forschungsalltag nicht mehr wegzudenken. Die Methode ist mittlerweile eines der wichtigsten Werkzeuge der Grundlagenforschung, da man Genfunktionen und deren Wechselwirkungen schneller untersuchen kann. Doch auch Züchter nutzen immer öfter das Tool, um den Züchtungsprozess zu beschleunigen. Denn mit CRISPR/Cas9 können verschiedene Genveränderungen wie Punktmutationen zielgerichteter vorgenommen werden als mit der klassischen Gentechnik. Der Trick ist, dass man dem schneidenden Teil (Cas9) eine zielsichere „Reisehilfe“ an die Hand gibt: Durch RNA-Moleküle, sogenannte Guide-RNAs, gibt man die Andockstelle im Erbgut vor.
Die Methode wird kontinuierlich weiterentwickelt. Schnell stellte sich die Frage, ob man mit einem Eingriff gleichzeitig mehrere Gene bearbeiten könnte. Diese „Multiplex-Editierung“ wird bereits seit längerem von Forschenden aus der ganzen Welt verfolgt. Nun gelang einem deutschen Team ein großer Schritt in diese Richtung. Die Ergebnisse wurden jüngst in der Fachzeitschrift „The Plant Journal“ veröffentlicht.

Die Experimente lieferten eine weitere wichtige Erkenntnis: Alles deutet darauf hin, dass die Verfügbarkeit von Cas9 der begrenzende Faktor bei solchen komplexen Mehrfachmutationen ist.
Bildquelle: © Jessica Lee Erickson
Genschere getunt
Das Forschungsteam der Martin-Luther-Universität Halle-Wittenberg (MLU) und des Leibniz-Instituts für Pflanzenbiochemie (IPB) entwickelte eine abgewandelte Methode, die Mehrfachmutationen möglich macht. Die Grundlage ist ein optimiertes Cas9-Gen (zCas9i): „Mit Hilfe dieses Bausteins wird in den Pflanzen deutlich mehr von dem Cas9-Enzym gebildet, das als Schere für das Erbgut fungiert“, erklärt Erstautor und Pflanzengenetiker Johannes Stuttmann vom Institut für Biologie der MLU.
An mehreren Genen ansetzen
Um die Genschere auf mehrere Zielgene „zu programmieren“, wurde der CRISPR-Komplex gleich mit einer Vielzahl unterschiedlicher Single-Guide-RNAs (sgRNA) ausgestattet und seine Aktivität bei wildem Tabak (Nicotiana benthamiana) und der Ackerschmalwand (Arabidopsis thaliana) getestet. Bei den Tabak-Experimenten enthielt die Genschere neun verschiedene sgRNAs, die acht unterschiedliche Gene anvisierten. In den Tests mit der Ackerschmalwand waren es sogar 24sgRNAs bzw. zwölf Zielgene.
Mithilfe von Markern sortierte das Team die Pflanzen aus, bei denen die Genschere ihre Arbeit erfolgreich verrichtet hatte. Das Ergebnis: Beim wilden Tabak trugen alle analysierten Pflanzen Mutationen in den acht Zielgenen. Bei A. thaliana war die Effizienz deutlich geringer, aber es konnte immerhin eine Mutantenlinie gefunden werden, bei der alle zwölf Zielgene durch Mutation ausgeschaltet waren. „Meines Wissens nach ist unsere Gruppe die erste, die so viele Zielgene auf einen Schlag erfolgreich ansprechen konnte“, sagt Stuttmann. Die Experimente lieferten eine weitere wichtige Erkenntnis: Alles deutet darauf hin, dass die Verfügbarkeit von Cas9 der begrenzende Faktor bei solchen komplexen Mehrfachmutationen ist.
Bislang mussten Mehrfachmutationen umständlich erzeugt werden: Pro Pflanze eine Mutation und dann schrittweise Kreuzungen der unterschiedlichen Mutanten. „Das ist nicht nur zeitaufwändig, sondern auch nicht in allen Fällen möglich“, erklärt Stuttmann. Der neue Ansatz ist damit ein bedeutender Durchbruch für Forschung und Züchtung.
Quelle:
Stuttmann, J. et al. (2021): Highly efficient multiplex editing: One-shot generation of 8x Nicotiana benthamiana and 12x Arabidopsis mutants. In: The Plant Journal, (25. März 2021), doi: 10.1111/tpj.15197.
Zum Weiterlesen:
- Wenn Träume wahr werden - Mehrere Gene gleichzeitig mit CRISPR/Cas veränderbar
- Was ist Genom-Editierung?
- Wie CRISPR/Cas funktioniert
Titelbild: Mithilfe von Markern sortierte das Team die Pflanzen aus, bei denen die Genschere ihre Arbeit erfolgreich verrichtet hatte. Unter UV-Licht erscheinen die Samen farbig - je nachdem welche Marker sie in sich tragen. (Bildquelle: © Jessica Lee Erickson)
