Revolution im Tröpfchen
Künstliche Chloroplasten aus Spinat-Thylakoiden und CETCH-Zyklus
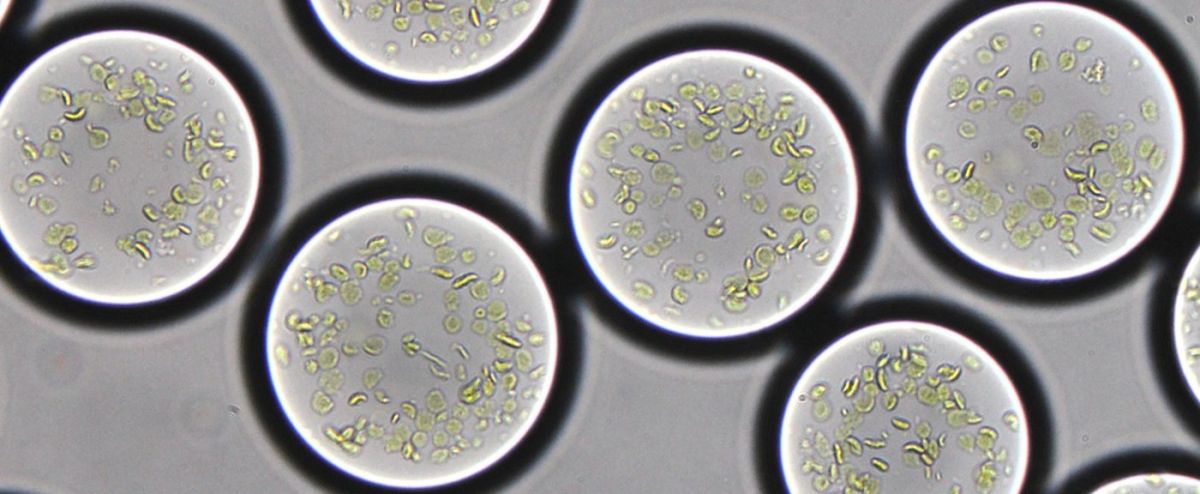
Die Mikrotröpfchen haben einen Durchmesser von ungefähr 90 Mikrometern. Sie beinhalten Spinat-Thylakoidmembranen sowie die notwendigen Enzyme für den CETCH-Zyklus. (Bildquelle: © MPI f. terrestrische Mikrobiologe/Erb)
Chloroplasten nutzen die Energie aus Sonnenlicht, um Kohlendioxid zu binden und organische Verbindungen herzustellen. Diesen Prozess wollen Forscher in künstlichen Chloroplasten nachempfinden – und sind hier einen großen Schritt weitergekommen.
Was die Energieautarkie angeht, ist jeder Grashalm uns Menschen überlegen. Denn nur Pflanzen können mittels Photosynthese die Energie aus dem Sonnenlicht zum Aufbau organischer Verbindungen nutzen. Jetzt ist es Wissenschaftlerinnen und Wissenschaftlern gelungen, eine Art künstlicher Chloroplasten nachzubauen. Diese binden Kohlendioxid rund 100 Mal schneller als alle bisherigen synthetisch-biologischen Chloroplasten und etwa vergleichbar mit natürlichen Chloroplasten in Bezug auf die zentrale Umwandlungsreaktion.
„Das Faszinierende an der Biologie ist ihre Modularität“, sagt Tobias Erb, Direktor am Max-Planck-Institut für terrestrische Mikrobiologie in Marburg, der das Projekt geleitet hat. Man kann einzelne Komponenten austauschen, ersetzen oder neu miteinander koppeln. So ging er auch bei der Herstellung der künstlichen Chloroplasten vor.
Ein Teil Natur, ein Teil Labor
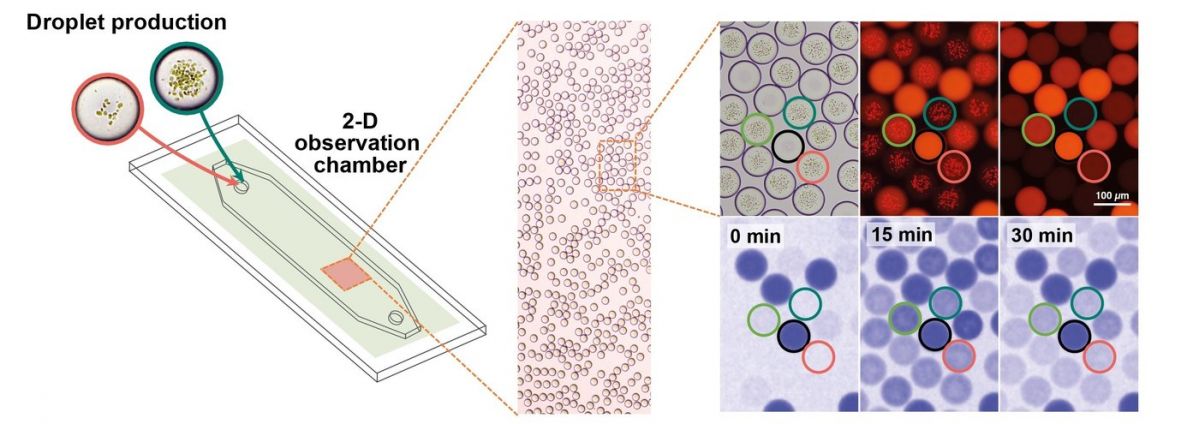
Die Mikrofluidik-Plattform zur Produktion von Mikrotropfen und ihrer Untersuchung in Echtzeit. Die Tröpfchen werden in einer Kammer gesammelt und ihre Aktivität mikroskopisch überprüft. Mit Hilfe von NADPH-Fluoreszenz lässt sich die enzymatische Aktivität überprüfen.
Bildquelle: © MPI f. terrestrische Mikrobiologe/Erb
Photosynthese läuft in zwei Schritten ab. Zunächst wird die Lichtenergie aufgenommen und in die energiereichen Moleküle ATP und NADPH umgewandelt. Danach wird diese Form der chemisch gebundenen Energie dazu genutzt, Kohlendioxid aus der Atmosphäre zu fixieren und energiereiche organische Verbindungen daraus herzustellen.
Erb und sein Team nutzten für den ersten Schritt die natürlichen Lichtsammelkomplexe aus Spinatpflanzen, auch Thylakoidmembran genannt. Diese kombinierten sie mit Enzymen eines ausgeklügelten neuen Stoffwechselweges zur Fixierung des Kohlendioxids, genannt CETCH-Zyklus. Er besteht aus 16 Enzymen und ist wesentlich effizienter in der Umwandlung von Kohlendioxid als der in Pflanzen natürlicherweise vorkommende Calvin-Benson-Bassham-Zyklus.
Angebot und Nachfrage anpassen
Die Basis des CETCH-Zyklus hatte Erbs Arbeitsgruppe bereits im Jahr 2016 entwickelt und seitdem ständig verbessert. Auch für den Einsatz in künstlichen Chloroplasten musste die bis dahin aktuellste Version CETCH 5.4 nochmals optimiert werden. Denn die Thylakoidmembran ist sauerstoffempfindlich, freie Sauerstoffradikale (ROS) können sie schwer schädigen oder zerstören. „Wir haben daher Oxidasen gegen eine biotinabhängige Carboxylase ausgetauscht“, erklärt Erb.
Die Stöchiometrie des aktuellen CETCH 7.0 passt jetzt auch besser zu dem, was die Photosysteme an ATP und NADPH liefern. „Vorher hat unser Zyklus zu wenig ATP verbraucht, jetzt stimmen die Proportionen“, sagt Erb.
Kleiner, günstiger, schneller
Um das Experiment weiter zu optimieren, hat Tobias Erb sich mit dem Labor von Jean-Christophe Baret vom Centre de Recherché Paul Pascal (CRPP) in Frankreich zusammengetan. Gemeinsam entwickelten sie eine Mikrofluidik-Plattform, die pro Sekunde Hunderte winzige Tröpfchen aus Wasser in Öl herstellen und mit den Thylakoidmembranen und Enzymen des CETCH-Zyklus ausstatten kann.
Video: "Synthetic chloroplast production" (in englischer Sprache)
Videoquelle: MPI f. terrestrische Mikrobiologe / youtube
Mit Hilfe von Fluoreszenzmikroskopie lässt sich ablesen, wie viel NADPH die Tröpfchen enthalten – ein Marker dafür, wie effizient die Photosynthese insgesamt abläuft. „Dieser Ansatz spart Zeit und vier- bis fünfstelligen Beträge an Kosten als wenn man diese Experimente im Mikro- oder Milliliter-Maßstab machen würde“, erläutert Erb.
Günstige Produktion von organischen Molekülen
Bisher sind die künstlichen Chloroplasten so konzipiert, dass sie ausschließlich Glykolsäure produzieren. Jetzt arbeiten die Wissenschaftlerinnen und Wissenschaftler daran, wirtschaftlich bedeutsame Stoffwechselprodukte herzustellen: Terpene für die Kosmetikindustrie zum Beispiel oder Vorstufen von Antibiotika. Dazu müsste man bis zu 60 oder 70 Enzyme zu einem neuen Stoffwechselweg zusammenschalten. Erb sagt selbst: „Etwas irre ist das schon.“ Aber möglich scheint es.
Außerdem möchte Erb versuchen, die 16 Enzyme des CETCH-Zyklus in lebende Systeme einzubauen, zunächst in Algen oder Cyanobakterien. Das könnte die Photosynthese in diesen Organismen um das zehnfache beschleunigen. Danach kämen auch Pflanzen als Empfänger in Frage. Doch da ihr Genom viel komplexer ist, sind Wechselwirkungen mit anderen Stoffwechselwegen wahrscheinlicher. Sollte es aber eines Tages klappen, wäre das ein ungeheurer Turbo für die Photosynthese – und damit vielleicht auch für den Ertrag.
Quellen:
- Miller, T.E. et al. (2020): Light-powered CO2 fixation in a chloroplast mimic with natural and synthetic parts. In: Science, (8. Mai 2020), doi: 10.1126/science.aaz6802.
- Gaut, N.J. und Adamala, K. P. (2020): Toward artificial photosynthesis. In: Science, (8. Mai 2020), doi: 10.1126/science.abc1226.
Zum Weiterlesen:
- Das künstliche Blatt rückt näher - Neuartiger Katalysator für die Wasserspaltung entwickelt
- Photosynthese aus dem Baukasten - Wissenschaftler kommen der künstlichen Photosynthese näher
- Let the sun shine - Forscher präsentieren Prototypen eines künstlichen Blattes
Titelbild: Die Mikrotröpfchen haben einen Durchmesser von ungefähr 90 Mikrometern. Sie beinhalten Spinat-Thylakoidmembranen, die die Lichtenergie einfangen, sowie die notwendigen Enzyme für den CETCH-Zyklus zur Fixierung von Kohlendioxid. (Bildquelle: © Max-Planck-Institut für terrestrische Mikrobiologie/Erb)
