„CRISPR-Kill“
Mit der Genschere lassen sich jetzt auch bestimmte Gewebetypen ausschalten

Hier entwickelt sich die Modellpflanze Arabidopsis thaliana normal. In den Experimenten sorgte das Team dafür, dass die Blütenbildung unterbunden wird. (Bildquelle: © iStock.com/dra_schwartz)
Mit CRISPR-Kill steht der Pflanzenforschung ein Werkzeug zur Verfügung, um die Ausbildung spezifischer Zelltypen zu verhindern. So können Forscherinnen und Forscher Entwicklungsvorgänge in Pflanzen künftig besser untersuchen.
Keine zwei Jahre nach dem Nobelpreis für die 2012 entwickelte molekulare Schere CRISPR/Cas9 haben Forscherinnen und Forscher des Karlsruher Instituts für Technologie eine besondere Weiterentwicklung präsentiert: CRISPR-Kill. Das Verfahren zerschneidet selektiv die DNA bestimmter Zelltypen an so vielen Stellen, dass die betroffene Pflanze das entsprechende Gewebe nicht mehr bilden kann. Das eröffnet der Forschung und der Gewebezüchtung neue Möglichkeiten.
Schnitte in konservierten repetitiven kodierenden Sequenzen
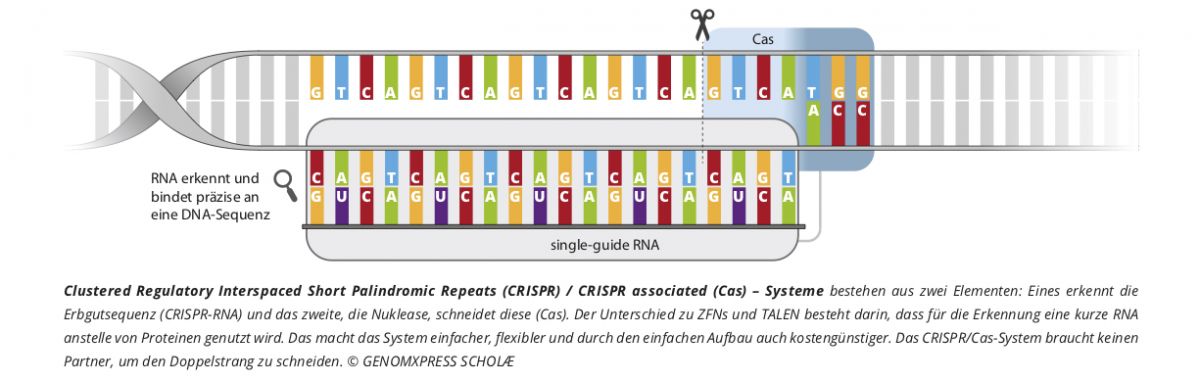
Entwickelt hat das Forschungsteam die Methode an der Modellpflanze Arabidopsis thaliana. Die ursprüngliche CRISPR/Cas9-Methode funktioniert so, dass eine RNA-Sequenz (guideRNA) den CRISPR/Cas-Komplex sehr spezifisch an die gewünschte, komplementäre Stelle im Genom lenkt und das Enzym Cas9 dort einen Doppelstrangbruch erzeugt. Dort kann dann eine Sequenz eliminiert, modifiziert oder ausgetauscht werden.
CRISPR-Kill hingegen ist so designt, dass es nicht den DNA-Doppelstrang an einer hochspezifischen Stelle im Genom durchtrennt, sondern an unzähligen. Das erfolgt dennoch sehr zielgerichtet: Bei der als Schere eingesetzten Nuklease Cas9 aus dem Bakterium Staphylococcus aureus tauschten die Fachleute dazu den üblichen konstitutiven Promotor aus. Indem er durch einen Zelltyp-spezifischen Promotor ersetzt wird, wird der CRISPR/Cas-Komplex nur in bestimmten Zelltypen aktiv. Wenn als Ziel der molekularen Schere nun noch eine funktionale repetitive DNA-Sequenz gewählt wird, entstehen so viele Schnitte, dass die DNA komplett ihre Funktion verliert. Alle Zellen des zugehörigen Zelltyps sterben ab.
Zelltyp-spezifische Promotoren für die Genschere
Ursprünglich wollten die Forscherinnen und Forscher eigentlich nur klären, mit welcher Methode Wiederholungen innerhalb repetitiver Sequenzen von der Zelle repariert werden. Sie konnten am Beispiel der 45S-rDNA-Wiederholungen zeigen, dass dies durch die klassische Verbindung nicht-homologer Strang-Enden geschieht und nicht durch homologe Rekombination. Schnitten sie jedoch gezielt in einem bei allen Kopien dieser 45S-rDNA-Sequenz konservierten Abschnitt, führte das zum Zelltod. Somit lag nahe, dass das Team eine Methode entdeckt hatte, in bestimmten Gewebetypen oder Entwicklungsstadien einen kontrollierten Zelltod auszulösen.
Blüten und Seitenwurzeln eliminiert
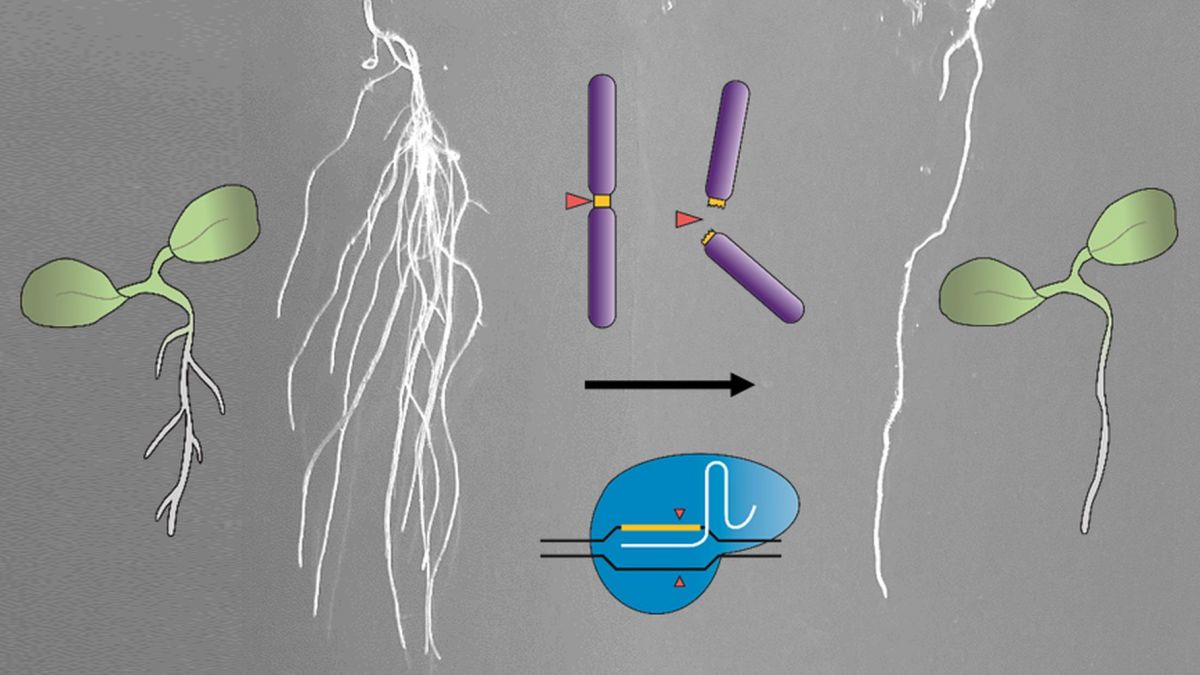
Mit CRISPR-Kill verhindern die Forschenden an der Modellpflanze Arabidopsis thaliana das Ausbilden von Seitenwurzeln.
Bildquelle: © Angelina Schindele, KIT
Um diese Hypothese zu überprüfen, kombinierten die Forscherinnen und Forscher die Genschere mit dem Promotor für das an der Blütenbildung beteiligte Gen APETALA1. Dieses Gen ist vor allem in der frühen Phase der Blütenbildung stark aktiv. Tatsächlich entwickelte ein Fünftel aller so behandelten Pflanzen keinerlei Blüten. Ein weiteres Fünftel entwickelte zwar Kelch- aber keine Kronblätter. Der Großteil der übrigen Pflanzen wies Zwischenformen aus. Anschließende Sequenzierungen ergaben, dass der Effekt von der Effizienz abhing, mit der die Doppelstrangbrüche erzeugt wurden.
Als weitere Bewährungsprobe konzipierte das Forschungsteam CRISPR-Kill so, dass es nur in Zellen der Seitenwurzeln aktiv werden und somit deren Ausbildung verhindern würde. Tatsächlich verringerte sich die Zahl der Seitenwurzeln um den Faktor drei. Richteten die Forscherinnen und Forscher CRISPR-Kill nicht gegen die 45S-rDNA, sondern gegen eine konservierte repetitive Sequenz im Centromer, halbierte sich immerhin noch die Zahl der Seitenwurzeln und ihre Länge. Abschließend wies das Team nach, dass diese Effekte vererbt werden und in der T1- und T2-Generation erhalten blieben.
Mehrere Anwendungsmöglichkeiten der Methode
Somit können grundsätzlich sowohl wiederholte Brüche in der 45S-rDNA wie auch in den Wiederholungen des Centromers genutzt werden, um den Zelltod auszulösen und entsprechende Pflanzenzelltypen zu eliminieren. Dass dabei unterschiedliche Effizienzen und unterschiedliche Phänotypen auftreten, werten die Fachleute eher als Vorteil für die Erforschung von Entwicklungsprozessen innerhalb der Pflanzen.
Während es bereits vereinzelte Methoden gibt, um bestimmte Zelltypen zu eliminieren, bietet CRISPR-Kill jedoch weitere Möglichkeiten. So ist es denkbar, gezielt einzelne Chromosomen auszuschalten. Nicht zuletzt ließe sich die Aktivität der molekularen Schere nicht nur auf Gewebetypen, sondern alternativ oder zugleich auf bestimmte Entwicklungsphasen beschränken. Und auch wenn die Methode zunächst nur an der Modellpflanze Arabidopsis thaliana erprobt wurde, so sollte es ein Leichtes sein, sie auf andere Pflanzenarten oder sogar auf Tiere und Pilze zu übertragen. Denn die genutzten Zielsequenzen sind artübergreifend stark konserviert.
Quelle:
Schindele, A. et al. (2022): Using CRISPR-Kill for organ specific cell elimination by cleavage of tandem repeats. In: Nature Communications, 13:1502, (21. März 2022), doi: 10.1038/s41467-022-29130-w.
Zum Weiterlesen auf Pflanzenforschug.de:
- Genscheren-Tuning - Gewebespezifische Genomeditierung mit CRISPR
- Armtausch zwischen Chromosomen - Mit Hilfe von CRISPR/Cas lassen sich Genome neu strukturieren
- CRISPR/Cas hat den Dreh raus - Inversionen machen Chromosomenabschnitte wieder für Rekombination zugänglich
Titelbild: Hier entwickelt sich die Modellpflanze Arabidopsis thaliana normal. In den Experimenten sorgte das Team dafür, dass die Blütenbildung unterbunden wird. (Bildquelle: © iStock.com/dra_schwartz)