Genscheren-Tuning
Gewebespezifische Genomeditierung mit CRISPR

Die Versuchspflanze Arabidopsis thaliana wird auch Ackerschmalwand genannt. (Bildequelle: © iStock.com/pkujiahe)
Die Genschere CRISPR/Cas9 hat sich als wertvolles Werkzeug in Medizin und Pflanzenforschung bewährt, um präzise Veränderungen am Erbgut vorzunehmen. Belgische Forscher haben jetzt eine Weiterentwicklung vorgestellt, mit der diese Eingriffe auf bestimmte Zellorgane oder Entwicklungsstadien begrenzt werden können.
Die Genschere CRISPR/Cas9 wird immer präziser. Forscher berichten in der aktuellen Ausgabe des Fachjournals „Plant Cell“, dass sie den Wirkungsbereich der Genschere nun gezielt auf bestimmte Bereiche des Organismus‘ beschränken können. Das ermöglicht Genomeditierungen ausschließlich für bestimmte Organe, Gewebe oder Phasen der Entwicklung.
Das erst wenige Jahre alte CRISPR/Cas-System hat eine Revolution in der Grundlagenforschung und Pflanzenzüchtung ausgelöst. Ursprünglich verbirgt sich hinter CRISPR/Cas9 ein Schutzmechanismus prokaryotischer Zellen, der dazu dient, Nukleinsäuren eines Eindringlings zu zerstören. Eine spezifische RNA-Sequenz lenkt das Enzym Cas an eine komplementäre Position der Ziel-DNA, wo das Enzym diese DNA durchtrennt und das betroffene Gen unwirksam macht.
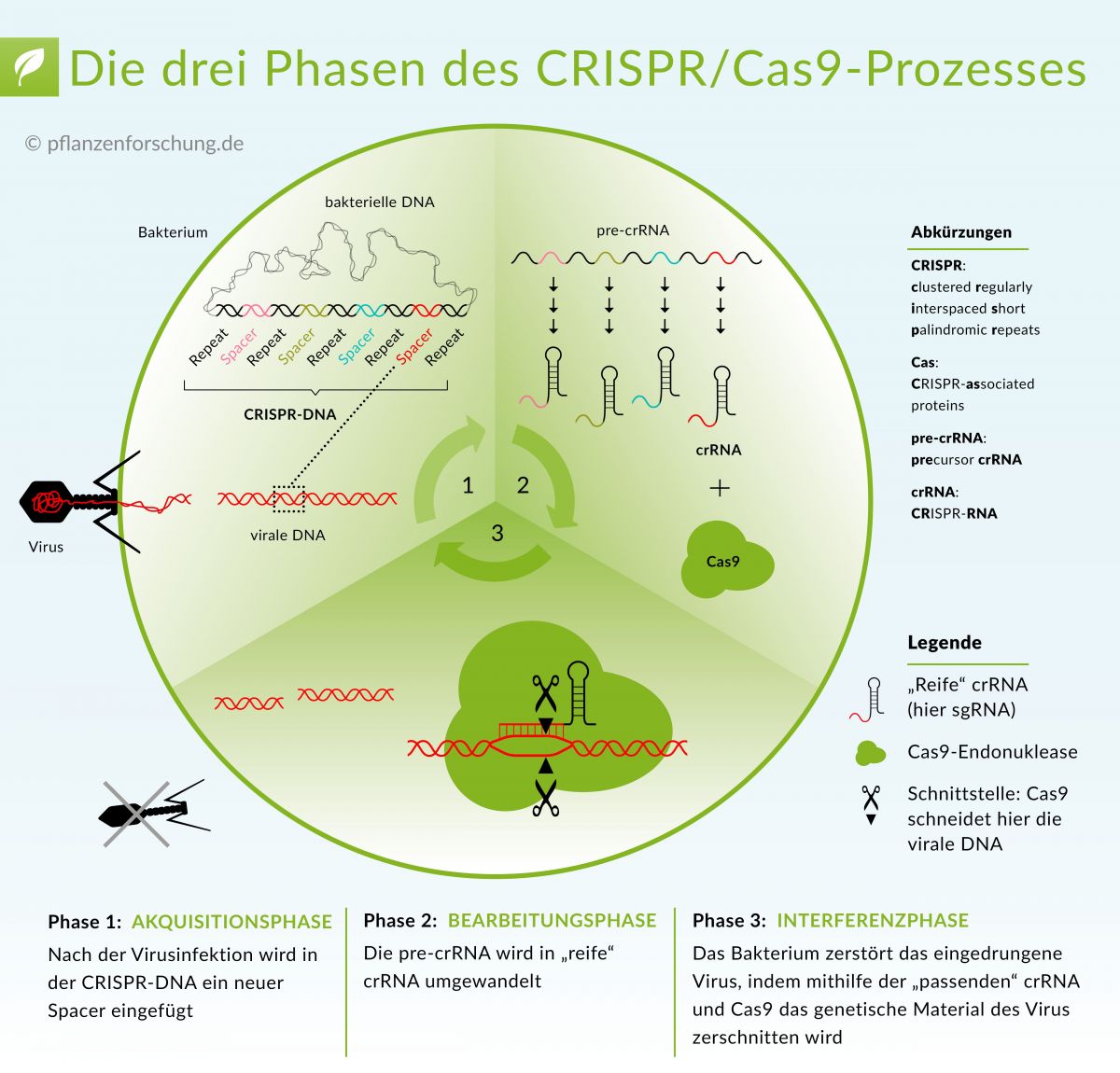
Ursprünglich verbirgt sich hinter CRISPR/Cas9 ein Schutzmechanismus prokaryotischer Zellen, der dazu dient, Nukleinsäuren eines Eindringlings zu zerstören.
Bildquelle: © Pflanzenforschung.de
In der Forschung wird der Mechanismus genutzt, um Gene auszuschalten oder an dieser Stelle neue DNA einzufügen. Manchmal werden von der Endonuklease Cas jedoch nicht nur die DNA des Ziel-Gens, sondern alle hinreichend komplementären Stellen der DNA – sogenannte Off-targets – geschnitten. Die Erhöhung der Spezifität der Genschere ist daher Ziel zahlreicher Forschungsprojekte.
Funktion existenzieller Gene aufklären
An der Universität Gent haben Wissenschaftler die Spezifität nun auch in anderer Hinsicht erhöht: Wirkte CRISPR/Cas bislang auf alle Zellen eines Organismus‘, lässt sich die Aktivität der CRISPR-TSKO getauften Weiterentwicklung auf bestimmte Zelltypen beschränken.
TSKO steht dabei für „tissue-specific knockout vector system“. Damit haben die Wissenschaftler ein großes Problem der Genforschung gelöst: Möchte man wissen, welche spezifische Funktion ein Gen hat, kann man es mit der Genschere ausschalten. Anschließend wird untersucht, welche Auswirkung dieser Eingriff hatte. Macht man dies jedoch bei essenziellen Genen, erfährt man wenig: Der veränderte Organismus stirbt. Immerhin ein Zehntel der proteinkodierenden Gene der Modellpflanze Arabidopsis thaliana gelten als essenziell. Zudem ist es auf diesem Weg unmöglich, homozygote Mutanten zu erzeugen, die für die weitere Forschung erforderlich wären.
Alternative Ansätze sind zum Beispiel das gewebespezifische Gen-Silencing, das jedoch häufig unvollständig oder zu unspezifisch wirkt und daher zu unklaren Phänotypen führt. Auch könnten transgene Vektoren verwendet werden, die dominant-negative Mutationen des Zielgens tragen. Die entstehenden Proteinversionen inhibieren die Funktion des Wildtypproteins, könnten aber auch mit anderen Genfunktionen interferieren. CRISPR-TSKO vermeidet diese Nebenwirkungen weitgehend. Dazu haben die Forscher das CRISPR/Cas-System mit einem gewebespezifischen somatischen Promotor gekoppelt. Damit, so die Überlegung, sollte es möglich sein, das Enzym Cas9 nur in ausgewählten Zelltypen, Geweben oder Organen zu exprimieren und dadurch nur dort die Genschere zu aktivieren.
Machbarkeitsbeweis erbracht
Zunächst testeten die Pflanzenforscher das Konzept an einer transgenen Ackerschmalwand, deren Zellen ein grün fluoreszierendes Protein (GFP) produzieren. Sie koppelten CRISPR-Cas9 mit dem nur in der Wurzelhaube exprimierten Promotor SOMBRERO und der Ziel-RNA für das GFP1-Gen bzw. das GFP2-Gen.

Am Beispiel der Ackerschmalwand erprobten die Forscher die neue Methode CRISPR-TSKO.
Bildquelle: © Safflle / wikimedia.org / CC-BY-SA-3.0
Sechs von elf (GFP1) bzw. drei von zehn (GFP2) Events zeigten daraufhin in der Wurzelhaube keinerlei Fluoreszenz mehr, während alle anderen Wurzelgewebe weiterhin GFP exprimierten. Das gleiche Bild zeigte sich bei jeweils drei Linien der T2-Generation. Somit funktioniert der Ansatz grundsätzlich, der Effekt ist streng somatisch und die gewebespezifische Gen-Stilllegung ist erblich.
Anschließend wandten die Forscher das Prinzip auf das Proteinkinase-Gen YODA an, bei dessen Knockout in allen Zellen einer Pflanze sich die Stomata anhäufen und das Wachstum arretiert. Schalteten die Forscher YODA jedoch mit der Genschere aus, die mit dem stomaspezifischen Promotor TOO MANY MOUTHS gekoppelt war, zeigte sich ein anderes Bild. Zwar häuften sich auch hier die Stomata an, aber das Wachstum der Pflanze blieb unbeeinträchtigt. Obendrein waren die Pflanzen fruchtbar, was bei anderweitig erzeugten YODA-Knockouts nicht der Fall ist. Dieses Ergebnis unterstreicht das große Potenzial der CRISPR-TSKO-Methode.
Vielseitige Methode mit einfachem Prinzip
Insgesamt demonstrierten die Pflanzenforscher ihre Methode erfolgreich an neun Genen, darunter vier, die für ein Gewebe oder Organ spezifisch sind. So gelang es beispielsweise, GFP gezielt nur in lateralen Wurzeln, aber nicht in den Primärwurzeln auszuschalten.
Das neue Verfahren sei kostengünstig, sehr flexibel und vergleichsweise einfach, betonen die Autoren der Publikation: CRISPR wird mit Cas9 oder einer anderen geeigneten Endonuklease kombiniert sowie mit einer auf das Zielgewebe abgestimmten Promotorsequenz. Dazu kommt noch mittels der etablierten Golden-Gate-Klonierung die übliche Ziel-RNA entsprechend des geplanten DNA-Eingriffs. Dann ist die gewebe- oder organspezifische Genschere komplett.
Quelle:
Decaestecker, W. et al. (2019): CRISPR-TSKO: A Technique for Efficient Mutagenesis in Specific Cell Types, Tissues, or Organs in Arabidopsis. In: The Plant Cell, (online 27. September 2019), doi: 10.1105/tpc.19.00454.
Zum Weiterlesen auf Pflanzenforschung.de:
- Wenn Träume wahr werden - Mehrere Gene gleichzeitig mit CRISPR/Cas veränderbar
- CRISPR/Cas9 in bester Gesellschaft - C2c2 ergänzt Cas9 auf RNA-Ebene
- CRISPR/Cas: Baukasten zur Editierung von Genomen wird erweitert - Basen-Editierung ermöglicht jetzt Korrektur von Punktmutationen in DNA und RNA
- Effiziente neue Genschere - Die Genschere CRISPR/Cpf1 arbeitet präziser als das bisherige Standardwerkzeug CRISPR/Cas9
Titelbild: Die Versuchspflanze Arabidopsis thaliana wird auch Ackerschmalwand genannt. (Bildequelle: © iStock.com/pkujiahe)
