Genomeditierung noch präziser
CRISPR ohne Schnitt
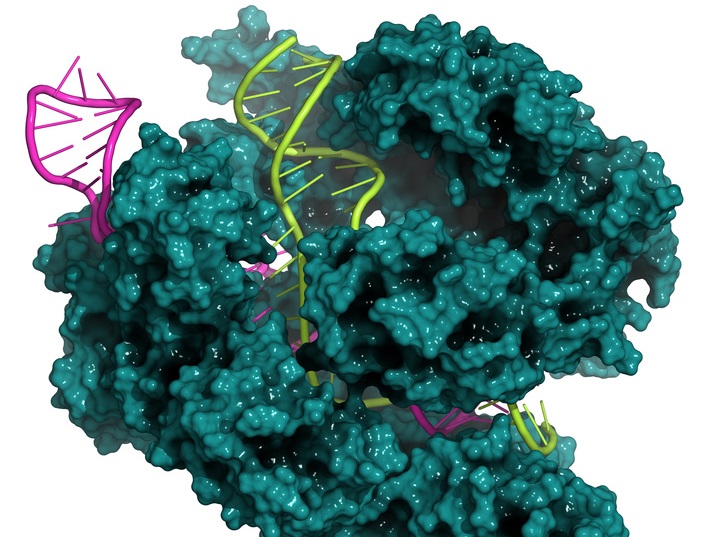
Mit CRISPR-Cas9 lassen sind Sequenzen im Genom gezielt, schnell und kostengünstig editieren. Doch die Methode hat auch Schwachstellen, die Forscher nun versuchen zu beheben. (Bildquelle: © molekuul.be/Fotolia.com)
Ein Enzym aus dem Immunsystem des Neunauges verhilft CRISPR/Cas zu noch mehr Präzision bei der Editierung einzelner Nukleotide.
Alles begann im Jahr 2012, als zwei Wissenschaftlerinnen das Abwehrsystem, das Bakterien gegen Viren einsetzen, zu einem Allzweckwerkzeug in der Genombearbeitung umfunktionierten. CRISPR/Cas ist gerade einmal vier Jahre alt und bereits weltweit verbreitet. Kein Wunder, denn die neue Genom-Editierungsmethode ist schnell, kostengünstig und ziemlich präzise.
CRISPR/Cas9 manchmal nicht ganz genau

Mit Hilfe eines Enzyms aus dem Neunauge gelang es Wissenschaftlern, die CRISPR/Cas9-Methode noch effektiver zu gestalten.
Bildquelle: © ValdisOsins/Fotolia.com
Mit dem CRISPR/Cas9 System lassen sich bestimmte Abschnitte eines Gens herausschneiden, korrigieren oder durch andere Abschnitte ersetzen. Das Prinzip ist einfach: Wissenschaftler führen das Cas9-Protein in die gewünschte Zelle ein, das an einem zuvor definierten Ort im Genom einen Doppelstrangbruch in der DNA verursacht. Ein ebenfalls in die Zelle eingebrachtes DNA-Stück nutzt die Zelle im Anschluss, um diesen Doppelstrangbruch zu reparieren. Manchmal versagt hier jedoch die Reparatur-Maschinerie der Zelle und es kommt zu unerwünschten oder unpräzisen Insertionen und/oder Deletionen.
„Während die Zelle einen defekten DNA-Doppelstrang repariert, finden viele Dinge gleichzeitig statt. Manchmal werden dabei Nukleotide in einer Weise entfernt, eingefügt oder mutiert, die wir nicht beeinflussen können“, erklärte Akihiko Kondo von der Kobe Universität in Japan gegenüber „The Scientist“ das Phänomen, das Wissenschaftler immer wieder im Labor beobachten.
Deaminase-Enzym bringt viele Vorteile
Kondo und seine Kollegen haben eine neue Methode entwickelt, welche dem CRISPR-System zu noch mehr Präzision verhilft. Dazu benutzten sie ein Deaminase-Enzym, das in der Lage ist, ein einzelnes Nukleotid in einem DNA-Strang zu verändern. Mit diesem Enzym schufen die Forscher ein CRISPR/Cas9-System, bei dem keine unerwünschten und teilweise zerstörerischen Doppelstrangbrüche mehr auftreten. Außerdem kommt das System ohne eine DNA-Matrize aus und minimiert auf diese Weise die Chance, dass kollaterale Mutationen in den DNA-Strang eingebaut werden. Denn die gewünschten Genomveränderungen stehen stets in Konkurrenz mit zufälligen Insertionen oder Deletionen. Das neue System ist nicht nur präziser, sondern reduziert auch die Mortalität, die durch Doppelstrangbrüche ausgelöst werden kann.
Einzel- statt Doppelstrangbruch
Das neue System beruht auf einer Kombination eines abgewandelten Cas9-Proteins aus dem Neunauge, das mit einer speziellen Deaminase (activation-induced cytidine deaminase (AID)) einen Einzelstrangbruch durchführt. Normalerweise verursacht das AID-Enzym Mutationen bei Immunglobulin-Genen, um eine Diversität im Immunsystem zu schaffen und es so reaktionsfähiger zu halten. AID agiert an einzelsträngiger DNA, wo es Cytosin durch Uracil ersetzt. Dieses Uracil wird bei der nächsten DNA-Replikation durch ein Thymin ersetzt.
Das neue System beruht auf einer Kombination eines abgewandelten Cas9-Proteins aus dem Neunauge, das mit einer speziellen Deaminase einen Einzelstrangbruch durchführt. Das Deaminase-Enzym ist in der Lage, ein einzelnes Nukleotid in einem DNA-Strang zu verändern.
Bildquelle: © Zerbor/Fotolia.com
Mutationsrate um das 1.000-fache erhöht
In Hefe, die nicht über ein zelleigenes AID-System verfügt, erwies sich das neue System als äußerst wirkungsvoll. So konnten die Wissenschaftler dank AID/Cas9 die Mutationsrate eines bestimmten Gens um das 1.000-fache erhöhen, während unerwünschte Fehl-Mutationen an anderen Stellen im Genom nur etwa 10-fach höher war als die normale Hintergrundmutationsrate.
Mit der neuen Methode lassen sich auch zwei Gene gleichzeitig bearbeiten, wenn zwei verschiedene Guide-RNAs zusammen mit dem Cas9-Deaminase-Komplex zum Einsatz kommen.
Uracil-DNA Glycosylase Inhibitor erhöht Effektivität
In nachfolgenden Versuchen fügten die Wissenschaftler dem AID-Cas9-Komplex ein weiteres Enzym hinzu: einen Uracil-DNA-Glycosylase-Inhibitor. Damit gelang es ihnen, die Umwandlung von Cytosin zu Thymin noch effektiver zu gestalten und aus Auftreten von Deletionen in tierischen Zellen zu minimieren. Das neue System scheint außerdem weniger toxisch auf Tier- und Hefezellen zu wirken als das herkömmliche CRISPR/Cas9-System.
Wissenschaftler entwerfen molekularen Baukasten
Mit der abgewandelten CRISPR/Cas9-Methode scheinen einige Schwachpunkte der ursprünglichen molekularen Genschere behoben zu sein. Bevor das System allerdings breite Anwendung findet, müssen zunächst die Nebeneffekte genauer untersucht werden. Ungeklärt ist auch, wie Wissenschaftler nur ein bestimmtes Cytosin umwandeln können, ohne angrenzende Cytosine zu verändern. Die Wissenschaftler um Akihiko Kondo arbeiten außerdem gerade daran, einen vollständigen molekularen Werkzeugkasten auf Basis des AID/Cas9-Systems zu erschaffen, mit dem sich ganz gezielt und mit möglichst wenigen Nebeneffekten alle Nukleotide der DNA umschreiben lassen.
Quelle:
Nishida, K. et al. (2016): Targeted nucleotide editing using hybrid prokaryotic and vertebrate adaptive immune systems. In: Science, (4. August 2016), DOI: 10.1126/science.aaf8729.
Zum Weiterlesen auf Pflanzenforschung.de:
- CRISPR/Cas9 in bester Gesellschaft - C2c2 ergänzt Cas9 auf RNA-Ebene
- Rasanter technologischer Fortschritt - CRISPR/Cas9 kann Punktmutationen ohne zu schneiden korrigieren
- Gibt es neben Chancen auch Risiken von CRISPR/Cas9? - Der Nutzen der Genom Editierung hängt davon ab, wie die Gesellschaft damit umgeht
- Wie CRISPR/Cas funktioniert - Eine einfache Technologie verbessert die Effizienz der Genom Editierung
- Was CRISPR/Cas leisten kann - Der Editierung von Genomen scheinen technologisch kaum noch Grenzen gesetzt
Titelbild: Mit CRISPR-Cas9 lassen sind Sequenzen im Genom gezielt, schnell und kostengünstig editieren. Doch die Methode hat auch Schwachstellen, die Forscher nun versuchen zu beheben. (Bildquelle: © molekuul.be/Fotolia.com)
