Mit TALEN zu resistenten Pflanzen
Das Projekt „ProTAL“

Im Labor: Reinigung von mehreren TALEN-Proteinen zum Test ihrer Aktivität. (Bildquelle: © Sebastian Becker)
Zu den Werkzeugen der Genomeditierung zählen neben Zinkfingernukleasen und CRISPR/Cas auch sogenannte TALEN-Proteine, die DNA sehr spezifisch schneiden können. Sie werden jedoch eher stiefmütterlich behandelt. Und das, obwohl sie wahrscheinlich ein enormes Potenzial für die Züchtung von neuen, widerstandsfähigeren Pflanzensorten haben. Das Projekt ProTAL will dem Werkzeug auf die Sprünge helfen und TALEN als Alternative zu CRISPR/Cas aufleben lassen.
TALEN-Proteine (TALEN: Transcription activator-like effector nuclease) sind molekularbiologische Werkzeuge, die 2010 entwickelt wurden und mit deren Hilfe man DNA-Sequenzen in lebenden Organismen zielgenau verändern kann. Man kann sie so designen, dass sie an jede beliebige Stelle im Erbgut binden und diese schneiden. Sie bestehen aus zwei Teilen: Einem DNA-Sequenz-erkennenden (TALE-Protein) und einem schneidenden (Nuklease) Teil. „TALEN-Proteine machten Genomeditierung für alle nutzbar, da sie einfach und verlässlich zu verwenden sind – das war der Startpunkt der Genome Editing-Revolution“, erklärt Prof. Dr. Jens Boch, der damals mithalf, den Mechanismus hinter den TALE-Proteinen zu entschlüsseln.

Steckbrief: „ProTAL“
- Förderprogramm: Nutzpflanzen der Zukunft, BMBF
- Laufzeit: 2018 - 2020
- Projektpartner: LUH
- Eintrag in unserer Projektdatenbank: ProTAL
Die Vorteile sind überzeugend: TALEN-Proteine sind nicht nur sehr effizient, sondern auch sehr spezifisch, da jede Bindungsdomäne einzelne DNA-Basen spezifisch erkennen kann.
Großer Beliebtheit in Laboren erfreuen sie sich dennoch nicht. Warum ist das so? „Bei CRISPR/Cas benötigt man eine RNA, die dem schneidenden Teil sagt, wo er aktiv werden soll – deren Herstellung ist recht einfach. Bei TALEN kommen Proteine zum Einsatz und diese sind recht aufwendig zu produzieren. Das dauert circa drei bis fünf Tage“, sagt Boch. Probleme machen zudem die Löslichkeit und die Stabilität der Proteine. Um Abhilfe zu schaffen und die Potenziale der TALEN-Proteine zu demonstrieren, wurde das Projekt „ProTAL“ ins Leben gerufen.
ProTAL war ein Projekt, das vom Bundesministerium für Bildung und Forschung (BMBF) im Förderprogramm „Nutzpflanzen der Zukunft“ gefördert wurde und von 2018 bis Ende 2020 lief.
Die Projektpartner und Ziele
ProTAL war ein Einzelprojekt, an dem Prof. Dr. Jens Boch vom Institut für Pflanzengenetik an der Leibniz Universität Hannover (LUH) mit seinem Team arbeitete.
Das Projekt hatte sich zum Ziel gesetzt, die Erzeugung der TALEN-Proteine zu vereinfachen. Maßgeschneiderte, direkt für eine bestimmte Genomeditierung nutzbare TALEN-Proteine sollten im Hochdurchsatzverfahren hergestellt werden. Perspektivisch will das Team um Boch TALEN-Proteine auch für andere Forschende produzieren und ihnen so die aufwendigsten Schritte bei der Produktion abnehmen.
Video: Das kann TALEN besser als CRISPR. Hier erklärt Sebastian Becker vom Institut für Pflanzengenetik an der Leibniz-Universität Hannover was TALEN sind und woran er genau forscht.
Ein Anwendungsfeld der Genomeditierungsmethode TALEN ist beispielsweise die Erzeugung krankheitsresistenter Pflanzen durch Maskierung der Bindungssequenzen von bakteriellen TALE-Proteinen im Pflanzengenom. TALE-Proteine von Pflanzenpathogenen aktivieren bestimmte Gene in ihren Wirten, um sie erfolgreich besiedeln zu können. Ein Beispiel ist die Aktivierung des Gens eines pflanzlichen Zuckertransporters, der zu einer besseren Nährstoffversorgung des Pathogens beiträgt. Die Maskierung der TALE-Bindungssequenzen im pflanzlichen Genom führt daher zu einer Inaktivierung solcher Virulenzfaktoren eines Pathogens.
Das Projekt hatte geplant, diese Einsatzmöglichkeit durch Erzeugung Xanthomonas oryzae-resistenter Reispflanzen zu testen. Dieser Krankheitserreger löst die Blattflecken- oder Streifenkrankheit aus und führt zu erheblichen Ernteausfällen, die auch nicht mit Pflanzenschutzmitteln einzudämmen sind.
Auf dem Plan stand auch die Frage, ob ein einzelnes Molekül – ein sogenanntes single chain-TALEN oder kurz scTALEN – für den DNA-Schnitt im Genom ausreicht. Denn bisher können nur zwei TALEN-Moleküle als Paar gemeinsam die DNA schneiden. Man kann sich das im übertragenen Sinn wie eine Schere vorstellen, die auch zwei Scherenblätter für den Schnitt benötigt. Bei anderen Genomeditierungsverfahren wie CRISPR/Cas benötigt man dagegen nur ein Molekül für die Arbeit – also wiederum weniger Aufwand beim Erstellen.
Das Vorgehen
Produktion von stabilen TALEN
Das Team hat ein modulares Klonierungs-Kit entwickelt, das für eine einfache und kostengünstige Anwendung optimiert wurde. Diese LEGO-ähnliche Klonierung ist inzwischen eine Standardmethode im Labor, bei der verschiedene Bauteile des TALEN gezielt zusammengefügt werden können.

Der Pipettierroboter übernimmt die Arbeit zum Klonieren von TALEs und TALENs.
Bildquelle: © Jens Boch
Ziel war ein vereinfachtes und automatisiertes System, bei dem die Laborarbeit Computer-gesteuert von Pipettierrobotern durchgeführt wird. Wichtig ist, dass die hergestellten Proteine löslich und danach auch noch aktiv sind. Dies wurde in Tests im Labor geprüft und viele Parameter untersucht, um die Bedingungen für eine optimale Aktivität zu finden. Auch die Lagerfähigkeit der Proteine war ein Qualitätskriterium, denn die Proteine müssen bis zum Einsatz aktiv bleiben. Sind die Proteine nach Einfrieren, Lagerung und Auftauen noch funktionsfähig, ist das Protein ausreichend stabil.
scTALEN
Im Labor wurden TALEN-Monomere (scTALEN) erzeugt, die mit zwei Nuklease-Domänen ausgestattet wurden. Man erhoffte sich, dass diese Monomere auch ohne Dimerisierung (TALEN-Paar) DNA sequenzgenau schneiden können.
Anwendung in Pflanzen
Bei der Genomeditierung durch TALEN werden zunächst die Zellwände der Pflanzenzellen enzymatisch entfernt. Es entstehen Protoplasten. Nach Zugabe spezieller Hilfssubstanzen können die TALEN-Proteine die „nackte“ Zellmembran überwinden und gelangen in das Zellinnere. Hier können sie aktiv werden und die gewünschte Genomeditierung durchführen.
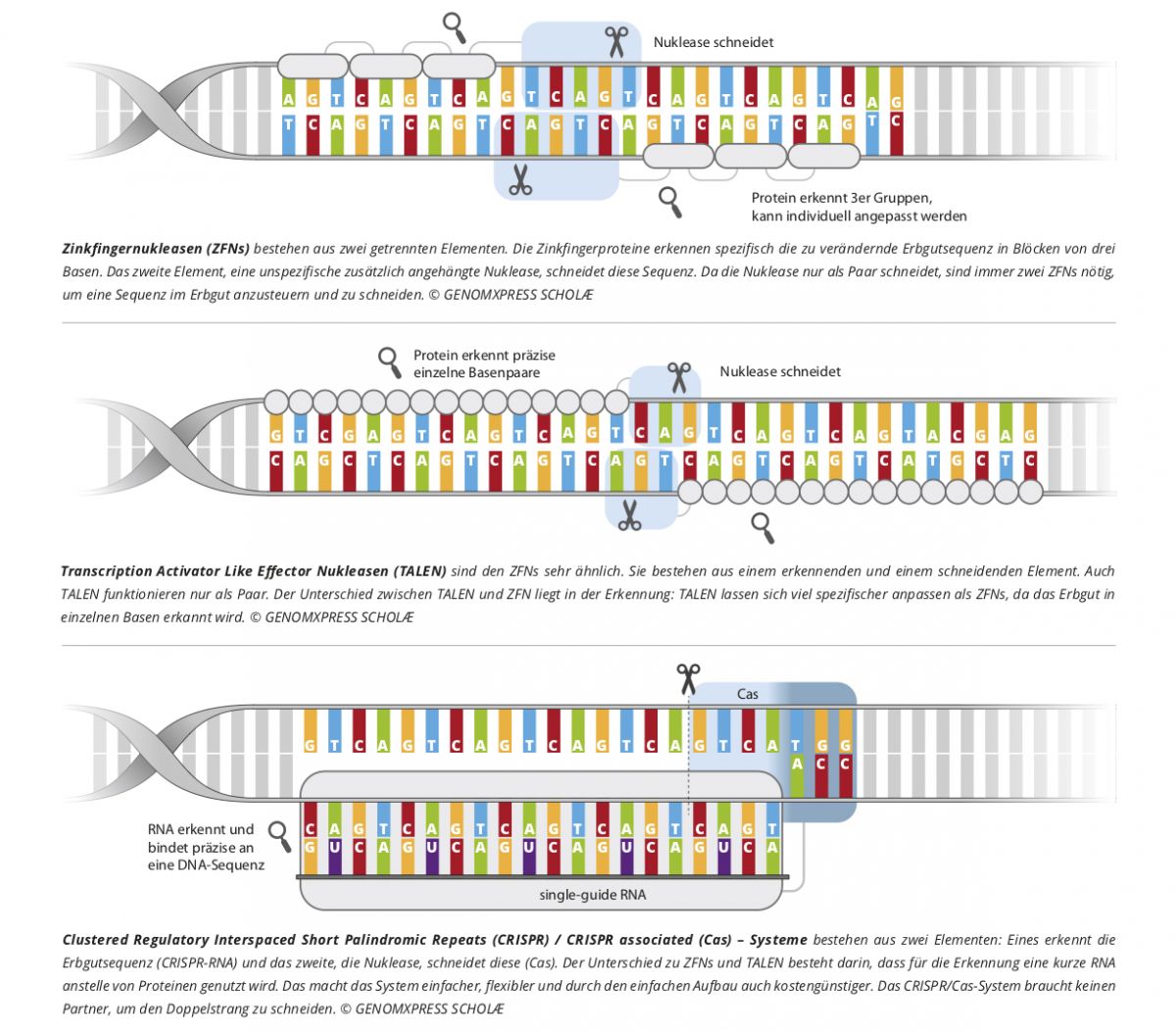
Das Genomeditierungswerkzeug TALEN erkennt und schneidet eine bestimmte DNA-Sequenz mit Hilfe von Proteinen. Diese Proteine namens TALE stammen ursprünglich aus Xanthomonas-Bakterien, die damit den Stoffwechsel von Wirtspflanzen beeinflussen können. Jedes TALE-Protein bindet an eine einzelne DNA-Base. Um eine ausreichende Spezifität bei der Bindung zu erreichen, werden 15 bis 20 TALE-Domänen aneinandergekoppelt. Am Ende des Proteinstrangs sitzt die Nuklease Fok1, die einen Schnitt erzeugt. Wissenschaftler:innen haben mit der Technik bereits gezielte Veränderungen in Pflanzen wie Mais und Tabak vorgenommen.
Anschließend könnten aus solchen Einzelzellen wieder ganze Pflanzen regeneriert werden, so dass eine gezielte Veränderung des Erbguts an die Nachkommen vererbt werden kann. Ein Vorteil von TALEN dabei: Es werden ausschließlich Proteine in die Pflanzenzelle übertragen und anschließend wieder vollständig abgebaut. Es können demnach keine transgenen Pflanzen entstehen, die fremdes Erbgut enthalten.
Die Ergebnisse
Mit den neuen und effizienteren Methoden wurde die Herstellung von TALEN-Proteinen etabliert und vereinfacht. Es ist nun nur noch ein Klonierungsschritt statt zwei notwendig und auch die Automatisierung der Konstruktion war erfolgreich. Dazu klärten die Untersuchungen auf, wie die TALEN-Proteine erzeugt werden müssen, um aktiv über Monate lagerfähig zu sein.
Der Ansatz, TALEN durch scTALEN mit zwei Nukleasedomänen zu ersetzen, war dagegen nicht erfolgreich. Die Monomere waren nicht ausreichend wasserlöslich für einen sinnvollen Einsatz als Genomeditierungs-Werkzeug. Das Fazit: Es ist einfacher, auch weiterhin ein TALEN-Paar für die Genomeditierung zu verwenden.
Auch wenn die TALEN-Aktivität bisher nicht in Reis zur Erzeugung Xanthomonas oryzae-resistenter Linien gezeigt werden konnte, wurden mit TALEN-Proteinen in Tabakzellen (Nicotiana benthamiana) erfolgreich einzelne Schnitte gesetzt. In diesem Modellorganismus konnten sogar vier TALEN-Proteine kombiniert und so gezielt Abschnitte im Erbgut entfernt werden. In Zukunft können nun bei Anwendungen, in denen strikt verhindert werden soll, dass fremdes Erbgut eingebaut wird, TALEN-Proteine genutzt werden. Auf den Erfolgen dieses Projekts aufbauend, könnte es sogar möglich werden, andere TALE-basierte molekulare Werkzeuge in Proteinform zu produzieren, um z. B. noch präzisere Änderungen im Erbgut zu erzeugen.
Zum Weiterlesen auf Pflanzenforschung.de:
- Modernste Methoden für schnelleren Züchtungserfolg - Die Förderrichtlinie „Nutzpflanzen der Zukunft” im Überblick
- Reis: Vom Labor auf den Teller - Funktionelle Genomforschung bringt Schwung in die Züchtung
- Was ist Genom-Editierung?
Titelbild: Im Labor: Reinigung von mehreren TALEN-Proteinen zum Test ihrer Aktivität. (Bildquelle: © Sebastian Becker)
PLANT 2030 vereint die vom Bundesministerium für Bildung und Forschung (BMBF) geförderten Forschungsaktivitäten im Bereich der angewandten Pflanzenforschung. Derzeit umfasst dies die nationalen Förderinitiativen: „Pflanzenzüchtungsforschung für die Bioökonomie I & II“, „Nutzpflanzen der Zukunft“, „Innovative Pflanzenzüchtung im Anbausystem (IPAS)“ und „Bioökonomie International“. Weitere Informationen finden Sie unter: PLANT 2030
