Ein Baukasten für Biologen zur Genom Editierung
Ein neues Werkzeug für die gezielte Veränderung von Genen mit Cas9
Mikroorganismen nutzen CRISPR/Cas für die Verteidigung gegen Viren. Doch noch immer ist unklar, warum manche Archaeen und zahlreiche Bakterien darauf verzichten. (Bildquelle: © fotoliaxrender / Fotolia.com)
Cas9, das Ribonukleoprotein, dass zielgerichtet DNA zerschneiden kann, ist in der synthetischen Biologie ein extrem wichtiges Werkzeug. Doch es ist bisher schwierig, das Protein und seine RNA in Zellen einzuschleusen. Jetzt stellen Wissenschaftler eine Baukastenmethode vor, mit der eigentlich nichts mehr schiefgehen kann. Damit kann die Methode zu einer Standardmethode für die Pflanzenforscherinnen und Forscher werden.
Wenn Biologen Veränderungen an der genomischen DNA im Zellkern vornehmen wollen, dann greifen sie häufig auf das Ribonukleoprotein Cas9 oder seine Verwandten zurück. Cas9 kann DNA sehr präzise schneiden. Nicht ganz so einfach ist es jedoch, das Protein mit der passenden sgRNA-Sequenz (die letztlich bestimmt, an welcher Stelle im Genom einer Zelle Cas9 zum Einsatz kommt) in die Pflanzenzelle einzufügen.
Johannes Stuttmann von der Martin-Luther-Universität Halle-Wittenberg hat jetzt ein Baukastensystem entwickelt, das diesen Prozess vereinfachen soll. Dicot Genome Engineering (pDGE) heißen diese Werkzeuge, auf Deutsch also etwa Genomeditierung von zweikeimblättrigen Pflanzen.
Ein Vektor mit Platzhalter
Der Baukasten beruht auf vorgefertigten Vektoren, in denen bereits Schlüsselelemente enthalten sind: Ein Markergen, welches eine Resistenz gegenüber einem Antibiotikum wie Kanamycin vermittelt und zur Selektion der erfolgreich transformierten Pflanzen notwendig ist; ein Gen, das für das Eiweiß Cas9 kodiert sowie eine Platzhalter-DNA. An Stelle dieses Platzhalters kann eine beliebige Sequenz für die im jeweiligen Experiment passende sgRNA eingefügt werden, die Cas9 später an seinen Wirkungsort im Genom leiten soll. Mit Hilfe des Golden Gate Cloning kann dann in einem einzigen Reaktionsschritt die Platzhalter-DNA gegen die benötigte Sequenz zur Erkennung des Zielgens ausgetauscht werden. Am Ende steht ein Vektor, der alle Komponenten für eine erfolgreiche Arbeit von Cas9 enthält. Diese können mit Hilfe von Agrobakterium in die Pflanzenzelle übertragen werden kann. „Das Prinzip ist extrem einfach und robust“, sagt Johannes Stuttmann, „wir haben bisher von anderen Laboren nur positive Rückmeldungen erhalten.“ Die Vektoren sowie die passenden Restriktionsenzyme können von jedem Labor einfach bestellt werden.
Besonders bei Deletionen erfolgreich
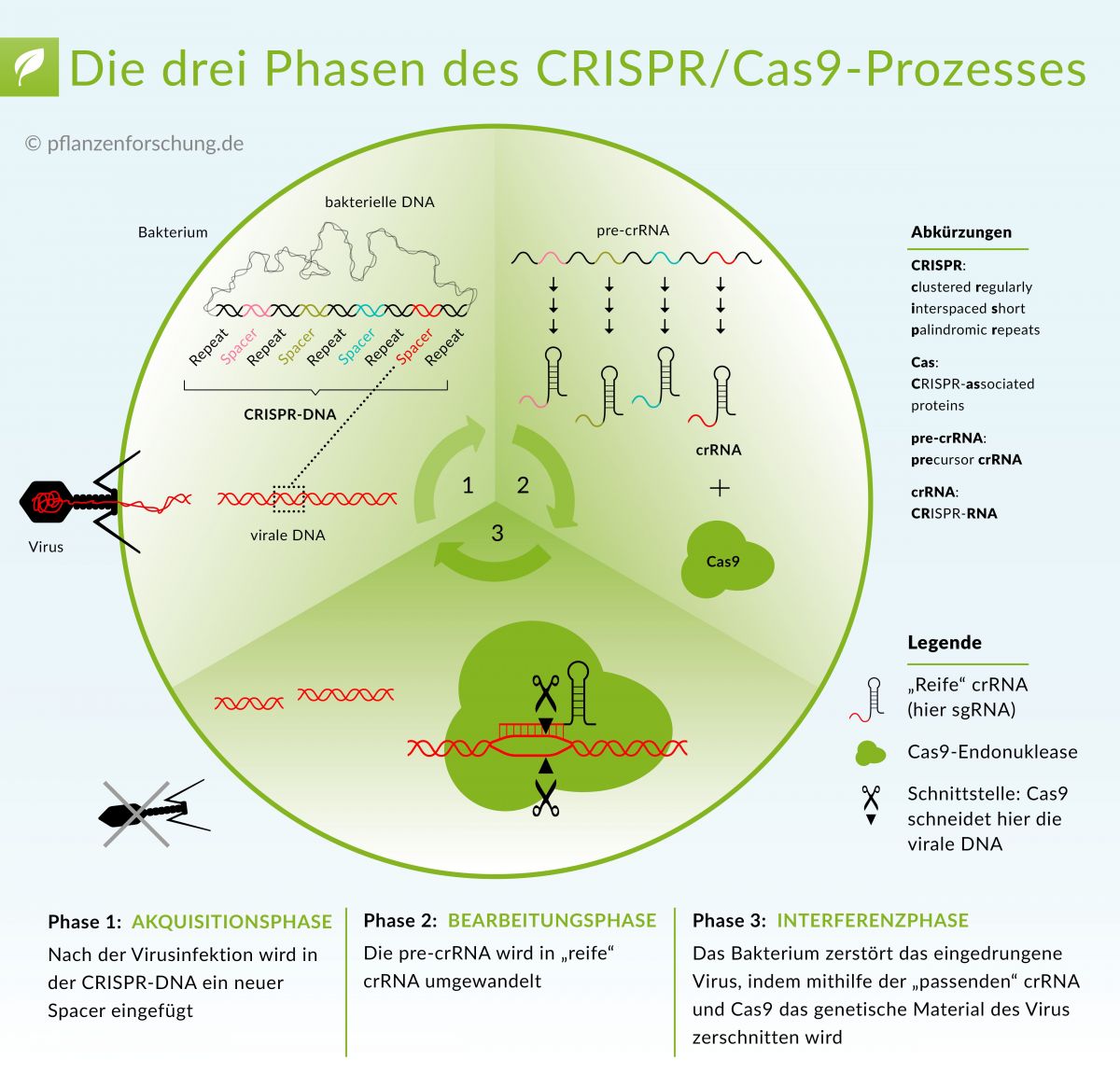
Die Funktionsweise des Typ II CRISPR/Cas-Systems. Der Ablauf des Prozesses erfolgt in drei Phasen: Akquisition eines neuen Distanzstückes, Bearbeitung der pre-crRNA in cr-RNA, Abbau der viralen DNA.
Bildquelle: © Pflanzenforschung.de
Besonders praktisch ist das Vektorsystem dann, wenn mit Hilfe von Cas9 Deletionen im pflanzlichen Genom verursacht werden sollen. Hierzu werden mehrere sgRNAs gleichzeitig benötigt, was dank der pDGE Vektoren ein einfacher Prozess ist. Eine Deletion von DNA-Abschnitten von bis zu 100 Basenpaaren Länge klappt recht häufig. Auch Deletionen von bis zu 120 Kilobasenpaaren sind durchaus möglich, aber in der Praxis nur sehr selten. Damit lassen sich Gene in ihrer Funktion verändern, oder sogar komplett entfernen.
Ein Nachteil des Systems ist in ihrer Einfachheit begründet. Sie besitzt eine geringere Flexibilität. Bei der heute oft genutzten modularen Klonierung ist diese größer. Allerdings stellt die modulare Klonierung mit ihren zahlreichen, aufeinander aufbauenden Reaktionsschritten höhere Ansprüche an die Geschicklichkeit. „Jeder, der geübt ist, kann auf modulare Klonierung zurückgreifen. Aber gerade für Anfänger ist unsere Technik unschlagbar“, sagt Stuttmann.
In Tieren zu viel, in Pflanzen zu wenig
Auch in tierischen Zellen arbeiten Labors weltweit mit der CRISPR/Cas-Methode. Doch die Probleme sind andere. In tierischen Zellen wird nach erfolgreicher Transformation das Cas9-Protein und die sgRNA oft sehr stark exprimiert. Dadurch kommt es zu unerwünschten off-target Effekten. Cas9 schneidet dann an Stellen, die gar nicht exakt auf die Sequenz seiner sgRNA passen, sondern dieser nur ähneln. In Pflanzen dominiert das gegenteilige Problem. Cas9 und die sgRNA werden nur in sehr geringen Mengen überhaupt exprimiert. Viele Transformationen bleiben ergebnislos.
Problematisch ist für alle Forschenden weiterhin, die Proteine und DNA für CRISPR/Cas9 effektiv in Zellen einzubringen Dass in den letzten Jahrzehnten zu wenig an effektiven Vektorsystemen zur Übertragung von Genen geforscht wurde, die jenseits der Grundlagenforschung an biologischen Systemen funktionieren, rächt sich heute. Durch die Möglichkeiten der Genom Editierung könnte die Erforschung geeigneter Vektoren eine Renaissance erfahren.
Auch das CRISPR/Cas-System selbst gibt noch viele Rätsel auf. CRISPR-Cas ist Teil des mikrobiellen Immunsystems, mit dem Mikroben sich gegen Viren verteidigen. Denn Viren gefährden nicht nur Menschen mit Krankheiten wie Schnupfen, Grippe oder Hepatitis. Sie sind auch für Prokaryoten gefährlich. Geschätzt töten Viren innerhalb von nur zwei Tagen die Hälfte der gesamten weltweiten Bakterienpopulation ab. Ein Kampf, der auf Ebene der Mikroorganismen tobte, lange bevor es höhere Organismen wie Pflanzen oder Tier gab.
Gibt es andere Funktionen als die Verteidigung?
Zu den Mysterien gehört zum Beispiel die Frage, warum CRISPR als ein so effektives Verteidigungswerkzeug, nicht von allen Mikroben genutzt wird. Etwa 90 Prozent aller Archaeen haben diese Waffe in ihrem Arsenal, aber nur etwa ein Drittel der bisher sequenzierten Bakterien. Warum einige Prokaryoten auf ein so effektives System verzichten, ist eines der großen Rätsel. Außerdem ist bisher unklar, ob CRISPR noch andere Funktionen hat als nur die reine Verteidigung. Auch ein weiterer Umstand gibt den Forschern noch Rätsel auf. Wie stellt CRISPR sicher, dass es nur virale DNA zwischen seinen „Spacern“ ablegt? Virale und bakterielle DNA ist chemisch nahezu identisch. Doch würde versehentlich ein Stück bakterieller-DNA in den „Spacer“-Bereichen der CRISPR-DNA landen, dann hätte die Mikrobe die schärfste Waffe ihrer viralen Verteidigung gegen sich selbst gerichtet. Grundlagenforschung zur bakteriellen Verteidigung bleibt im Brennpunkt der Wissenschaft und wird noch viele Aha-Effekte ans Licht bringen.
Quellen:
- Ordon, J. et al. (2016): Generation of chromosomal deletions in dicotyledonous plants employing a user-friendly genome editing tool. In: The Plant Journal 89, 155, (14. November 2016), doi: 10.1111/tpj.13319
- Ledford, H. (2017): Five big mysteries about CRISPR’s origins. In: Nature 541, 280, (19. Janur 2017), doi: 10.1038/541280a.
Zum Weiterlesen auf Pflanzenforschung.de:
- Was CRISPR/Cas leisten kann – Der Editierung von Genomen scheinen technologisch kaum noch Grenzen gesetzt
- Wie CRISPR/Cas funktioniert – Eine einfache Technologie verbessert die Effizienz der Genom-Editierung
- Cas9 – ein molekularbiologisches Mikroskalpell: Bakterielle Abwehr umfunktioniert
Aktuelles Video zum Thema CRISPR/Cas9:
Weitere Informationen zum Thema:
- Bioökonomie.de: Interview mit Holger Puchta zur Genom Editierung: "Pflanzen züchten mit der Genomschere CRISPR-Cas"
Titelbild: Mikroorganismen nutzen CRISPR/Cas für die Verteidigung gegen Viren. Doch noch immer ist unklar, warum manche Archaeen und zahlreiche Bakterien darauf verzichten. (Bildquelle: © fotoliaxrender / Fotolia.com)
