Kurzer Auftritt, langfristige Wirkung
Transiente Expression von CRISPR/Cas9 in Weizen geglückt

Weizen ist eine der wirtschaftlich bedeutendsten Getreidearten der Welt. (Bildquelle: © davemhuntphoto/Fotolia.com)
Forschern ist es gelungen, mit zwei neuen Ansätzen der Genomeditierung, Weizen erfolgreich zu transformieren ohne dabei bleibenden Spuren der Methode im Erbgut zu hinterlassen. Lediglich die gezielten Mutationen bleiben stabil erhalten.
Um die Funktion von Genen zu verstehen oder um neue genetische Eigenschaften in Pflanzen zu nutzen, wird in Forschungslaboren überall auf der Welt immer häufiger zur neuen „Wunderwaffe“ der Genomeditierung gegriffen: Die sich rasant verbreitende CRISPR/Cas9-Methode basiert auf einem Verteidigungsmechanismus von Bakterien (Prokaryoten) gegen Viren.
Der technologische Fortschritt bleibt rasant: Ständig wird die Methode angepasst und verfeinert. Das lässt sie immer präziser und damit auch sicherer werden. Die Präzision des Werkzeugs führte dazu, dass erste Studien zur Gentherapie beim Menschen in China und den USA unter strengen Auflagen bereits genehmigt wurden. Einige bisher als unheilbar eingestufte Krankheiten könnten dadurch ihren Schrecken verlieren. Ausgeschlossen bleiben Eingriffe in die Keimbahn von Menschen.
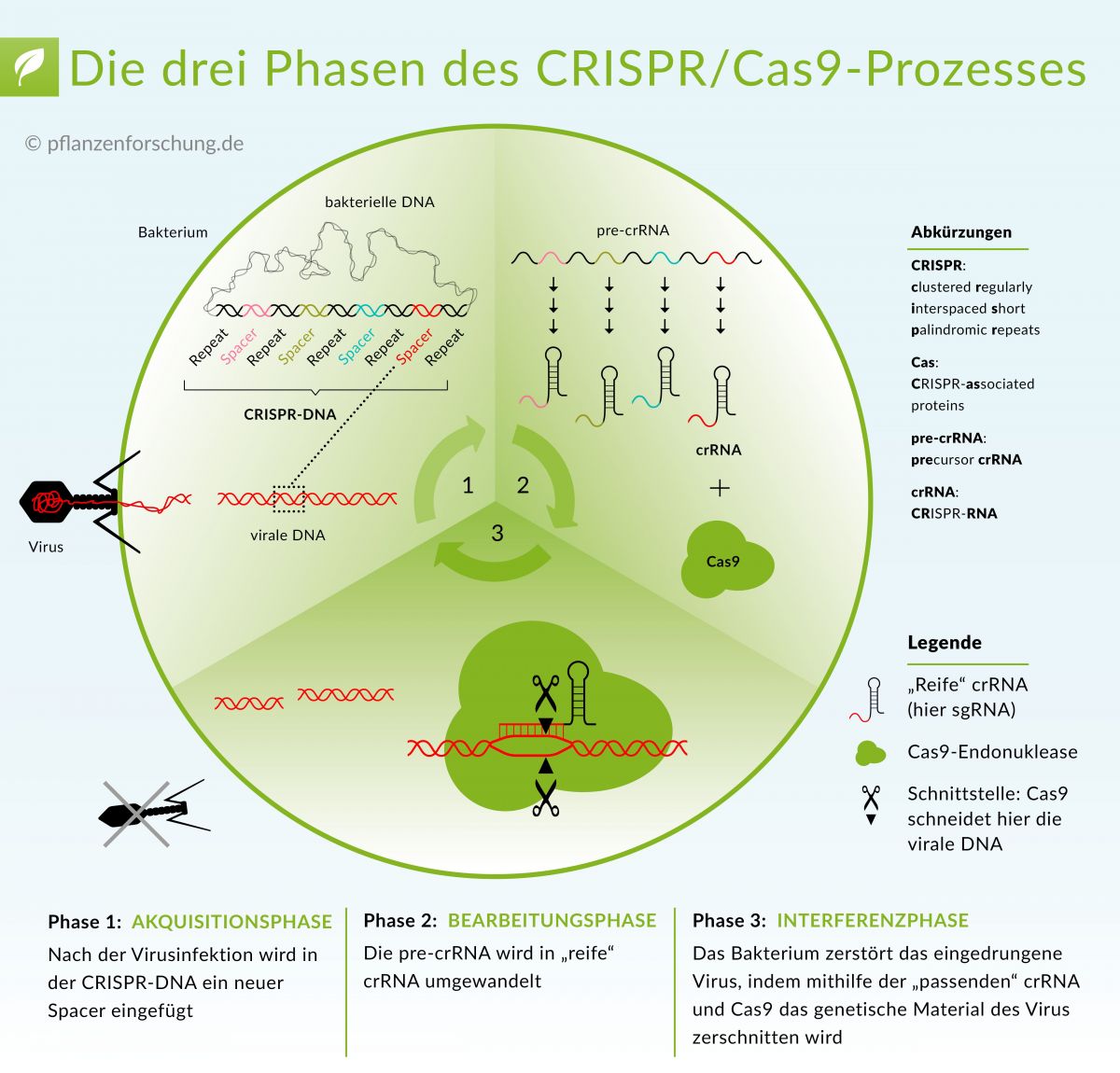
So funktioniert das CRISPR-Cas9-System - das Verteidigungsystem von Bakterien gegen Viren. Mehr dazu erfahren ...
Bildquelle: © Pflanzenforschung.de
Aber zurück zu den Pflanzen. Eine neue Studie reiht sich in die methodische Verfeinerung von CRISPR/Cas9 ein. Dabei nutzen die Wissenschaftler zwei relativ einfache und seit Jahrzehnten etablierte Verfahren, die es in Kombination mit der Genomeditierung möglich machen, Weizen gezielt genetisch zu verändern, ohne dabei Spuren fremder DNA im Erbgut der Pflanzen zu hinterlassen.
Nicht jede Pflanze lässt sich leicht transformieren
Um Mutationen, d. h. strukturelle Veränderungen von Genen oder Genomabschnitten, künstlich zu erzeugen, wird CRISPR/Cas9 normalerweise in die Pflanzenzelle eingebracht, wo sich der Komplex an bestimmte, vordefinierte Bereiche des Erbguts anheftet und mithilfe des Cas9-Proteins einen Doppelstrangbruch der DNA verursacht. Bei der zelleigenen DNA-Reparatur erfolgt dann die Modifikation des Erbmaterials, beispielswiese der gezielte Austausch von Basenpaaren (Punktmutationen). Da auch viele evolutionäre Veränderungen durch Punktmutationen hervorgerufen werden, genügen oftmals kleinste Veränderungen, um große Wirkung zu erzielen. Sei es, dass Gene ausgeschaltet werden oder dass die von ihnen gebildeten Proteine eine andere Struktur und damit Funktion erhalten.
Weizen stellt für die Forscher eine besondere Herausforderung dar. Wie andere Getreidearten gehört auch das weltweit bedeutende Getreide Weizen zur Gruppe der schwer zu transformierenden Pflanzen. Aber auch andere Kulturpflanzen, z. B. Sojabohnen oder Baumwolle, gehören dazu. Um beim Weizen zielgenau Mutationen hervorzurufen, müssen Wissenschaftler tiefer in die technologische Trickkiste greifen.
Eingriff ohne Spuren
Um die Maschinerie zur Genomeditierung zu nutzen, muss ein modifiziertes Cas9-Enzym und die auf ein Zielgen abgestimmte guide RNA in die Pflanzenzelle integriert werden. Woo et al. gelang es 2015 bereits, Protoplasten unterschiedlicher Pflanzen vorrübergehend mit dem Cas9-Enzym und guide RNA auszustatten und das, ohne fremd-DNA in die Zielzellen einzubringen. Allerdings ist der Protoplasten-Ansatz aufwändig und es ist bisher nur bei wenigen Pflanzen gelungen, Protoplasten so zu isolieren, dass daraus wieder überlebensfähige Pflanzen regenerieren.
Die Idee dahinter ist jedoch interessant – damit lassen sich Transgen-freie Pflanzen entwickeln, bei der die Veränderungen im Erbgut durch Hilfsmittel erzeugt wurden, die keine Spuren hinterlassen, da sie nicht im Genom der Mutanten eingebaut werden.
Weizenzellen unter Beschuss
Diese Idee verfolgend, gelang es Forschern nun, Weizen-Mutanten aus Gewebekultur (Kallus) zu regenerieren, welche nur vorrübergehend das CRISPR-Cas9-System exprimierten (transiente Genexpression). Dafür beschossen sie die Pflanzenzellen mit einer sogenannten „Genkanone“, um den CRISPR/Cas9-Komplex zu übertragen. Sie übertrugen dabei entweder direkt DNA oder aber RNA, also die in vitro Transkripte der Cas9-kodierenden Sequenz und die passende künstlich hergestellte guide RNA (sgRNA).

Aus Kalluszellen können vollständige neue Organismen regenerieren. Diese Fähigkeit nutzen die Forscher für ihre Experimente und erzeugten im Labor Weizen-Mutanten.
Bildquelle: © KANDA EUATHAM / Fotolia.com
Getestet haben die Forscher ihren Ansatz an hexaploidem Brotweizen (Triticum aestivum) und tetraploidem Hartweizen (Triticum durum). Insgesamt sechs Gene hat das Forscherteam dabei gezielt verändern wollen. Die Wissenschaftler erzeugten mit ihrem Ansatz reinerbige (homozygote) Weizen-Mutanten (T0 Generation), die keine nachweisbaren Transgene aufwiesen und die gewünschten Mutationen enthielten. Die Mutationen wurden ebenfalls erfolgreich an die nachfolgenden Generationen weitergegeben, wie die Forscher berichten.
Effizient und schnell
Die Methoden waren erfolgreich, wie die Wissenschaftler feststellten, da sie sehr spezifisch die gezielt gesetzten Mutationen in den Mutanten hervorriefen. Darüber hinaus berichten die Forscher, sei erstmalig eine Genomeditierung in Hartweizen nachweisbar geglückt. Und wenn keine Transgene mehr im Erbgut verankert sind, sind auch keine zeitaufwändigen Rückkreuzungen nötig, um das CRISPR/Cas-System nach getaner Arbeit zu beseitigen, was manchmal schwierig und teilweise gar nicht möglich ist.
Die Forscher weisen dabei auf einen weiteren Vorteil hin: Die Pflanzenzellen mussten nicht mit Herbiziden oder Antibiotika behandelt werden, um die erfolgreich transformierten Pflanzen auszufiltern. Dies sparte 2-4 Wochen im gesamten Prozess, sodass die Pflanzenkeimlinge bereits 6-8 Wochen nach dem Beschuss auf den Erfolg der Transformation untersucht werden konnten.
Die beiden beschriebenen Ansätze (DNA oder RNA) könnte der Studie zufolge auch auf andere Pflanzenarten angewendet werden. Und könnten sowohl die Grundlagenforschung als auch die angewandte Forschung beschleunigen, so die Hoffnung der Forscher.
Quelle:
Zhang, Y. et al. (2016): Efficient and transgene-free genome editing in wheat through transient expression of CRISPR/Cas9 DNA or RNA. In: Nature Communications 7:12617, (25. August 2016), doi: 10.1038/ncomms12617.
Zum Weiterlesen:
- CRISPR/Cas wird auch unsere Nahrungspflanzen verändern - Wie gehen wir damit um?
- Rasanter technologischer Fortschritt - CRISPR/Cas9 kann Punktmutationen ohne zu schneiden korrigieren
- Neuer, schneller, präziser - Mit CRISPR/Cas9 zu herbizidresistenten Kulturpflanzen
- Wie CRISPR/Cas funktioniert
- Was CRISPR/Cas leisten kann
Titelbild: Weizen ist eine der wirtschaftlich bedeutendsten Getreidearten der Welt. (Bildquelle: © davemhuntphoto/Fotolia.com)
