Die Welt zwischen DNA und Proteinen
RNA ist weit mehr als nur die Schnittstelle zwischen Erbgut und Eiweißen

Die RNA ist ein vielseitiges Molekül: Sie trägt die genetische Information und kann verschiedene 3D-Strukturen annehmen. Hier im Bild ist ein Teil einer tRNA zu sehen. (Bildquelle: © Yikrazuul / wikimedia.org; CC BY-SA 3.0; Detail)
Ribonukleinsäuren sind Träger der genetischen Information, Hauptakteure in der Proteinherstellung und in der Lage, chemische Reaktionen zu beschleunigen. Diese Besonderheit macht RNA für die Funktionsweise von Lebewesen und für viele technische Anwendungen zugleich unersetzlich. In diesem Hintergrundbeitrag nehmen wir die chemische Schwester der DNA unter die Lupe.
„Leben ist Information“, formulierte der Physiker Erwin Schrödinger in seinem Buch "Was ist Leben?" Mitte des 20. Jahrhunderts. Damals fragten sich Wissenschaftler noch, was die molekulare Basis des Lebens sei. Mittlerweile haben die Naturwissenschaften einen sehr tiefen Einblick in die Funktionsweise von Zellen und Lebewesen erlaubt. Forscher entschlüsseln die Zusammenhänge zwischen Erbgut und Erscheinungsbild von Organismen mit zunehmender Genauigkeit.
Mehr als eine bloße Zwischenstufe

Ein Henne-Ei-Problem für Naturwissenschaftler: Wie ist Leben entstanden? Die RNA-Welt-Hypthese liefert eine plausible Erklärung.
Bildquelle: © grendelkhan / wikimedia.org; CC BY-SA 2.0
Gemäß dem sogenannten „zentralen Dogma der Molekularbiologie“ findet in der Zelle ein Fluss von Informationen statt. Der genetische Code in der DNA wird in die RNA-Sprache transkribiert und als mRNA wiedergegeben. Letzte dient als Vorlage zur Herstellung von Proteinen. Die Maxime für Naturwissenschaftler bis circa Ende des 20. Jahrhunderts war: Ein Gen ergibt eine RNA, und eine RNA ergibt ein Protein.
Diese universelle Regel ist grundsätzlich richtig, vereinfacht jedoch die Komplexität von biologischen Prozessen. Ausnahmen sind bekannt, wie die Reverse Transkriptase, die RNA in DNA umschreibt. Das Enzym wurde 1970 in Retroviren, wie dem HIV, beschrieben. Solche Viren, die zu den sogenannten RNA-Viren gehören und die am weitesten verbreiteten Viren sind, haben ein Erbgut, das aus RNA besteht. Während der Virusinfektion sorgt die Reverse Transkriptase dafür, dass das Erbgut des Virus in DNA umgeschrieben wird und der Infektionsprozess von fremden, DNA-basierten Genomen gelingen kann.
Der RNA-Welt-Hypothese zufolge ist RNA das älteste Molekül, aus dem das Leben entstanden ist. Das bedeutet, dass RNA nicht als ein bloßer Zwischenschritt von der DNA zu den Proteinen angesehen werden kann.
Viele DNA-Abschnitte, die für kein Protein kodieren und viralen Ursprungs sein können, wurden lange Zeit als DNA-Müll betrachtet (engl.: „junk DNA“), der von Generation zu Generation weitergegeben wurde. Heute wissen wir, dass diese Abschnitte oft für regulatorische Informationen kodieren und lebenswichtige Funktionen haben.
Kleine Moleküle mit großer Wirkung: RNA als Steuereinheit der Genexpression
Die wichtigste Funktion der RNA ist vermutlich die Beteiligung an der Genexpression. Zusätzlich zu den RNA-Spezies, die direkt involviert sind (mRNA, tRNA und rRNA), gibt es zahlreiche andere Varianten des Moleküls, wie z. B. die MicroRNA. Diese kleinen RNAs sind in dem Prozess der RNA-Interferenz beteiligt und sorgen dafür, dass die Boten-RNAs (mRNA) abgebaut oder nicht transkribiert werden. Dadurch können sie Gene gezielt ausschalten.
Diese Erkenntnis veränderte nicht nur die Grundlagenforschung. Die gezielte Steuerung von Genen wurde schnell für zahlreiche Anwendungen von der Medizin bis hin zur Landwirtschaft interessant.

Mögliche Anwendung: RNA-Arzneimittel. Allerdings gibt es dabei auch Herausforderungen.
Bildquelle: © iStock.com/drKaczmar
RNA-Medikamente für die Medizin
Ein Beispiel ist die Entwicklung von RNA-Medikamenten. Bei vielen Krebsformen sind bestimmte Gene überproportional aktiv. Die erhöhte Herstellung des EGFR (Abkürzung für engl. epidermal growth factor receptor)-Proteins ist für eine Art von Hirntumor im Menschen verantwortlich. Ein Therapieansatz ist, mithilfe von der RNA-Interferenz die mRNA für EGFR stillzulegen. So sind RNA-Medikamente sehr spezifisch und haben weniger Nebenwirkungen als Chemotherapeutika. Auch sind allergische Reaktionen und Unverträglichkeiten mit therapeutischer RNA eher unwahrscheinlich.
Eine Hürde ist allerdings die Verabreichung des Medikaments. Die direkte Einspritzung in das Gehirn oder andere Organe ist nicht praktikabel. Durch eine orale Applikation werden die RNA-Moleküle bereits im Mund oder im Magen zerstört und abgebaut. Und selbst wenn die RNA an die richtigen Organe gelangt, muss diese noch die fetthaltige Zellmembran durchdringen, um in das Zellinnere zu gelangen, um wirksam zu werden. Für Moleküle mit einer negativen Ladung wie die DNA und RNA, ist diese Barriere kaum zu überwinden. Das Molekül müsste maskiert, also speziell verpackt werden.
Allerdings sind Studien bekannt, in denen der Nachweis gelang, dass durch Ernährung aufgenommene RNA aus Pflanzen den Stoffwechsel beeinflussen kann. Zumindest bei Mäusen konnte diese Wirkung nachgewiesen werden. Eine Weiterentwicklung für eine orale Applikation erscheint somit als prinzipiell möglich, wenn verstanden wird, wie es diesen RNA Molekülen gelingt allen Hindernissen zum Trotz, aktiv zu bleiben.
RNA-Sprays für die Landwirtschaft
Auch in der Landwirtschaft gibt es vielversprechende Anwendungsmöglichkeiten. Pflanzenforscher und Unternehmen versuchen, mithilfe von sogenannten „RNA-Sprays“ Pflanzen vor Feinden zu schützen. Diese Sprays enthalten kleine RNA-Moleküle. Werden diese von Krankheitserregern oder Fressfeinden aufgenommen, entfaltet sich ihre Wirkung. Mittels RNA-Interferenz können lebenswichtige Gene des Krankheitserregers abschalten werden. Andere RNA-Sprays können auf Pflanzengene einwirken und die Transkription bestimmter pflanzeneigener Gene verändern, sodass z. B. bestimmte Verteidigungsmechanismen verstärkt werden.
Aber auch bei diesen Anwendungen bleibt die Anlieferung der RNA an die richtige Stelle ein Problem. Die Aufnahme der RNA-Moleküle durch die pflanzenpathogenen Insekten unterliegt ähnlichen Hürden wie die der RNA-Medikamente. Ähnlich der oralen Applikation können kleine RNA Moleküle durch die Spaltöffnungen in das Innere von Pflanzen gelangen. Dort angelangt müssen sie aber noch die Zellwände durchdringen, ehe sie das Cytoplasma erreichen und wirken können.
Erste Feldversuche mit RNA-Sprays laufen bereits in einigen Ländern. Erweisen sich diese als effektiv, wären die RNA-Sprays eine Alternative zur Gentechnik und zum Einsatz von Pestiziden. Kleine RNA wirken auf die Expression der Gene ohne die Erbsubstanz der Pflanze (oder des Insekts) zu verändern. Dadurch erzielte Änderungen in der Genexpression sind vorübergehend solange die RNA anwesend ist.

Für die Landwirschaft könnten RNA-Sprays ein mächtiger Wandel sein: Pflanzen wären ohne Gentechnik oder Pestizide gegen Schädlingen resistent. Aber Vorsicht ist geboten: Die Folgen für das Ökosystem und die Entwicklung von Resistenzen bei den Schädlingen sind noch nicht geklärt.
Bildquelle: © Oliver Mohr / Pixelio.de
Der große Vorteil von RNA-Molekülen ist, dass diese sehr spezifisch wirken können. Designed zum Abschalten von Genen, die nur im Schädling vorkommen, bleiben diese für andere Lebewesen unschädlich. RNA-Sprays werden jedoch kein Allheilmittel sein. So wie bei herkömmlichen Pflanzenschutzmitteln auch, können sich Resistenzen entwickeln. Wenn die Zielsequenz der Boten-RNA beispielsweise durch eine Punktmutation verändert wird, verliert die kleine RNA ihre Wirkung.
Längerfristige Folgen für das Ökosystem müssen vor einer Zulassung untersucht werden. Eines kann dabei mit großer Wahrscheinlichkeit ausgeschlossen werden: die Anreicherungen von RNA in der Umwelt. RNA Moleküle sind aufgrund ihrer chemischen Struktur viel kurzlebiger als viele herkömmliche Pestizide. DDT ist ein gutes Beispiel für Langlebigkeit. Aus dem Grund ist der Einsatz seit langem verboten und dieses Verbot ist eine der Ursachen für die Zunahme von Malaria.
In gute Form gebracht: RNA als vielgestaltiges Molekül
Nukleinsäure – RNA und DNA – sind in ihrer chemischen Struktur sehr ähnlich. RNA hat lediglich eine zusätzliche Alkohol-Gruppe im Zucker-Phosphat-Rückgrat des Moleküls, und die Nukleinbase Uracil ersetzt das Thymin der DNA. Maßgeblich ist allerdings die Tatsache, dass RNA nicht wie die DNA als Doppel-, sondern als Einzelstrang besteht. Somit hat RNA ein viel größeres Entfaltungspotential als DNA und kann viele verschiedene räumliche Strukturen annehmen.
Ribozyme: RNA als Enzyme
Es besteht ein enger Zusammenhang zwischen der Struktur und der Funktion einer Verbindung. Ähnlich einem Schlüssel, der ein Türschloss nur dann öffnen oder schließen kann, wenn er die „richtige“ Form hat, ist auch die Wirkung von Molekülen abhängig von der dreidimensionalen Struktur. Dasselbe gilt für die Hauptakteure des Stoffwechsels – die Enzyme in Zellen. Nur wenn diese Proteine die „richtige“ 3D-Struktur haben, können sie eine Wechselwirkung mit Metaboliten eingehen und chemische Reaktionen beschleunigen („katalysieren“).
Die Vielgestaltigkeit der RNA erlaubt die Wechselwirkung mit vielen Molekülen und Metaboliten. So sind auch einige RNA in der Lage, chemische Reaktionen zu katalysieren. Ribozyme (hergeleitet aus Ribonukleinsäuren, also RNA, und Enzymen) werden sie genannt. Die Entdeckung von RNA-Molekülen mit enzymatischer Aktivität führte in den 1980iger Jahren zur Ehrung mit dem Chemie-Nobelpreis.
Ribozyme werden auch für medizinische Anwendungen untersucht. Ein Ansatz ist es, mit ihrer Hilfe das Erbgut von Viren zu zerschneiden, um Menschen und Tiere vor einer Virus-Infektion zu schützen. Wie alle Moleküle unterliegen auch Ribozyme einer natürlichen Selektion. Diese versucht man gezielt im Labor zu beschleunigen, indem man immer neue Kombinationen von Molekülen schafft. Den künstlichen Selektionsdruck im Labor bezeichnet man als in vitro Selektion, um die Wirkung und Effektivität von Ribozymen zu steigern.
Dieses Video veranschaulicht den Unterschied zwischen Aptameren und Spiegelmeren.
Videoquelle: © www.biotechnologie.tv
Aptamere: RNA als Passstücke
Eine weitere, vielversprechende Nutzung der RNA sind die sogenannte Aptamere. Aptamere sind DNA-, RNA- oder Proteinmoleküle die mit höher Affinität und Spezifizität an einer bestimmten Substanz anhaften. RNA-Moleküle sind für Aptamere die besten Kandidaten: Aufgrund ihrer Vielgestaltigkeit und der Möglichkeit eines in vitro Selektionsprozesses, sind sie geeigneter als DNA oder Proteine.
Das Zusammenbringen von zwei (oder mehr) Molekülen ohne eine chemische Reaktion, ist vergleichbar mit dem Lego-Prinzip. Dieses hat den Vorteil, dass aus einem Grundbaukasten heraus eine immense Vielfalt von molekularen Strukturen geschaffen werden kann. Durch diese Vielfalt eignen sich RNA-Aptamere z. B. als Biosensoren oder können für die molekulare Bildgebung eingesetzt werden. Aber auch als Gegengifte werden diese benutzt. Eine Studie beschrieb die Entwicklung eines RNA-Aptamers, das an der hochgiftigen Substanz Rizin des Wunderbaums (Ricinus communis) anhaftet. Somit kann der Giftstoff nicht an sein eigentliches Ziel-Molekül binden und seine toxische Wirkung ausüben.
Spiegelmere: unzertrennliche RNA
Ein Problem für die Arbeit mit RNA-Molekülen ist den Abbau von diesen durch Ribonukleasen (RNase). Diese sind Enzyme, die RNA abbauen, indem die Phosphatdiesterbindungen spezifisch aufgespalten werden. Spiegelmere (auch L-Ribonukleinsäure-Aptamere genannt) bietet eine Lösung dafür. Die Nukleotid-Bausteine enthalten eine besondere Form des Zuckers Ribose. Anstatt der natürlichen Form R-Ribose ist das Spiegelbild-Molekül L-Ribose vorhanden. Spiegelmere können nicht von RNasen angegriffen werden und sind stabiler. Da Spiegelmere keine natürlichen Substanzen sind, können sie nicht aus einer DNA-Vorlage transkribiert werden, d. h. sie müssen chemisch synthetisiert werden.
Sequenz und Struktur: RNA als Multitalent
Die Tatsache, dass die RNA sowohl genetische Informationen trägt als auch verschiedene 3D-Strukturen übernehmen kann, macht sie zu einem Multitalent. So können einige RNA-Moleküle durch die Abfolge der RNA-Basen mit bestimmten Sequenzen in der DNA paaren, und gleichzeitig durch ihre räumliche Struktur an Proteinen oder anderen Molekülen binden.
RNA als Reiseleiter zur DNA
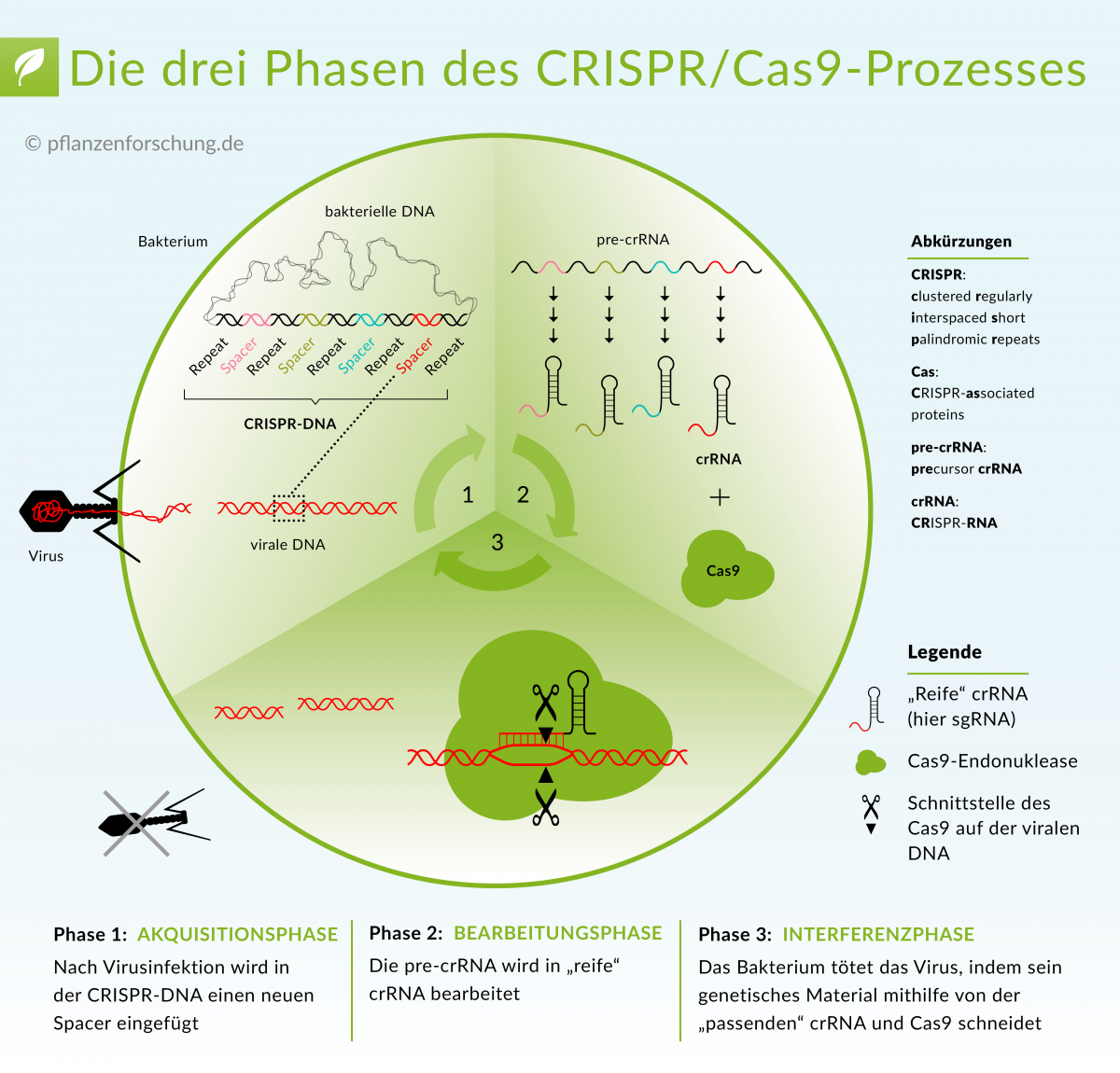
Die CRISPR/Cas-Technologie, die zurzeit in der Forschung und Anwendung Furore macht, basiert auf den besonderen Eigenschaften der RNA. Mehr dazu unter: Wie CRISPR/Cas funktioniert.
Bildquelle: © Pflanzenforschung.de
Im diesen Sinn ist RNA eine Art Reiseleiter von Proteinen an bestimmte Stellen des Erbguts. Ein bekanntes Beispiel ist die „Leit-RNA“ (zum Beispiel die crRNA oder auch die sgRNA) des CRISPR/Cas-Systems. Die Leit-RNA kann das Protein Cas9 an spezifischen DNA-Stellen bringen und einen Schnitt in der DNA bewirken. Somit bietet das System vielversprechende Möglichkeiten in der gezielten Abänderung der DNA-Sequenz (der sogenannten Genom Editierung). Die Einfachheit des CRISPR/Cas-Prozesses bringt zurzeit bahnbrechende Fortschritte in der Pflanzenforschung, Ökologie und Medizin voran.
Riboswitches als Schalter des Stoffwechsels
Ein weiteres Beispiel für die Vielseitigkeit der RNA sind die sogenannten Riboswitches. Diese sind Teile von mRNA, die aufgrund ihrer 3D-Struktur während der Genexpression nicht „gelesen“ werden können. Bestimmte Metaboliten können diese räumlichen Strukturen auflösen oder befestigen und bewirken, dass die mRNA gelesen oder nicht gelesen wird. Ein Beispiel ist das sogenannte TPP-Riboswitch in der Ackerschmalwand (Arabidospis thaliana). Wenn das Vitamin Thiamin in der Zelle vorhanden ist, bindet es an den TPP-Riboswitch, und das Gen für die Synthese von neuer Thiamin ist ausgeschaltet. Ohne Thiamin löst sich der Riboswitch auf, so dass neues Vitamin von der Zelle synthetisiert wird. Riboswitches sind durch ein solches molekulares Feedback direkt am Stoffwechsel einer Zelle beteiligt.
Die RNA-Welt ist nicht genug
Die Tatsache, dass die Vielseitigkeit der RNA lange Zeit nicht bekannt war, hat auch damit zu tun, dass die Stabilität des Moleküls geringer ist. Aufgrund einer zusätzlichen Alkohol-Gruppe im Rückgrat des Moleküls, ist RNA weniger robust als die DNA. Auch greifen zelleigene RNasen die RNA an und bauen diese ab. Die Aufreinigung und Analyse der RNA im Labor ist dadurch erschwert.
Neue Erkenntnisse in den letzten Jahrzehnten zeigten die erstaunliche Reichweite der RNA. Gleichzeitig entwickelten Wissenschaftler bessere Methoden für die Bestimmung der Sequenz und Struktur der RNA. Die Kosten für die chemische Synthese von RNA Molekülen sind heute um eine Vielzahl geringer als noch vor einigen Jahren, was die Entwicklung von RNA-Medikamenten oder Sprays ermöglichen wird.
Viele Anwendungen, die in diesem Beitrag diskutiert wurden, finden im Moment noch keine oder nur einer begrenzten Nutzung in der Pflanzenforschung oder Landwirtschaft. Durch die Vielseitigkeit der RNA erwarten wir jedoch eine Weiterentwicklung der Breitenanwendung. Technische Fortschritte in der RNA-Biologie werden den Weg für neue Anwendungen der RNA ebnen.
Quellen und weiterführende Informationen:
- Berens, C. et al. (2015): RNA aptamers as genetic control devices: The potential of riboswitches as synthetic elements for regulating gene expression. In: Biotechnology Journals 10: 246–257 (15. Januar 2015), doi: 10.1002/biot.201300498.
- Christensen, N.M. et al. (2010): Advances in imaging RNA in plants. In: Trends in Plant Sciences 15(4): 196-203 (11. Februar 2010), doi:10.1016/j.tplants.2010.01.005.
- Hesselberth, J.R. et al. (2000): In Vitro Selection of RNA Molecules That Inhibit the Activity of Ricin A-chain. In: The Journal of Biological Chemistry 275(7): 4937–4942 (18. Februar 2000), doi: 10.1074/jbc.275.7.4937.
- Paige, J.S. et al. (2011): RNA Mimics of Green Fluorescent Protein. In: Science 33(6042): 642-646 (29. July 2011), doi: 10.1126/science.1207339.
- Regalado, A. (2015): The next great GMO debate.In: MIT Technology Review (11. August 2015).
- Rüdel, S. und Meister, G. (2007), RNA-Interferenz – Von der Grundlagenforschung zum Medikament. In: Biospektrum (Sonderausgabe zur Biotechnica 2007).
Zum Weiterlesen auf Pflanzenforschung.de:
- Ohne Pestizide, Einsatz trotzdem fraglich – Mit RNA Interferenz endlich effizientes Mittel gegen Kartoffelkäfer
- Projektporträt „dsRNAguard“ – Kulturpflanzen schalten die Gene ihrer Feinde ab
- Kleine RNAs regulieren die Abwehr in der Tomate
- Mikro-RNAs in Pflanzen: Neuer Regulator entdeckt
- Pflanzliche RNA greift in den Stoffwechsel ein
- „Innere Uhr“ beeinflusst alternatives Spleißen der RNA
- Wie CRISPR/Cas funktioniert – Eine einfache Technologie verbessert die Effizienz der Genom Editierung
- Neue Methode zur Strukturaufklärung von RNA – Tiefensequenzierung und räumliche Nähe von Atomen für 3D
- Direkte RNA-Sequenzierung
Titelbild: Die RNA ist ein vielseitiges Molekül: Sie trägt die genetische Information und kann verschiedene 3D-Strukturen annehmen. Hier im Bild ist ein Teil einer tRNA zu sehen. (Bildquelle: © Yikrazuul / wikimedia.org; CC BY-SA 3.0; Detail)
