Transparente Logistik
Eine neue Methode macht messbar, wie Mineralstoffe in den Wurzelgeweben verteilt werden

Anhand der Modellpflanze Ackerschmalwand erprobten die Forscher:innen ihre neue Methode zur Erforschung des Mineralstoffwechsels.(Bildquelle: © Carl Davies / CSIRO / CC BY 3.0)
Wie Nährstoffe von den Wurzeln aufgenommen und transportiert werden, ist wesentlich für ein gesundes Wachstum. Jetzt ist es erstmals möglich, diese Prozesse für zahlreiche Mineralstoffe und Gewebeschichten gleichzeitig zu analysieren. In Zukunft könnten mit solchen Daten die Transportwege in Pflanzen optimiert und die Effizienz der Nährstoffnutzung erhöht werden. Aber auch die Anreicherung toxischerElemente könnten Züchter:innen so in oberirdischen Pflanzengeweben verhindern.
Sie sind die „Warenannahme“ der Pflanzen: Über die Wurzeln gelangen Nährstoffe, aber auch toxische Stoffe aus dem Boden in die unterschiedlichen Gewebe der Pflanzen. Dabei stellen die Wurzeln sicher, dass Nährstoffe in geeigneter Menge an die jeweiligen oberirdischen Pflanzenorgane geleitet werden und dass Giftstoffe in den empfindlichen Stammzellen keine kritische Konzentration erreichen. Obwohl die Pflanzenforschung bereits viele dieser Prozesse aufklären konnte, verbleiben zahlreiche Fragen. Um sie zu beantworten, müsste man vollständig verstehen, welche Transportwege bzw. Membrantransporter an der Verteilung der verschiedenen Stoffe mitwirken. Genau das ermöglicht jetzt eine neu entwickelte Methode.
Bisherige Messverfahren mit Limitationen
Die meisten Ionentransporter in den Wurzeln weisen klare Lokalisationsmuster auf, die gewebe- und zelltypspezifisch sind. Auch die Entwicklungsphasen der Wurzeln und verschiedene inneren und äußeren Signale beeinflussen sie. Es ist naheliegend, dass diese Muster damit zusammenhängen, wie die Wurzeln Nährstoffe von außen nach innen und entlang der Längsachse der Wurzel verteilen. Allerdings sind die Zusammenhänge zwischen Ionentransporter und Mineralstoff nicht immer eindeutig: Manche Transporter sind für mehrere Elemente zuständig, und bestimmte Elemente können von mehr als einem Transporter befördert werden.
Es existieren bereits einige Methoden, um die Verteilung bestimmter Elemente in Pflanzengewebe zu untersuchen, darunter die Röntgenfluoreszenzmikroskopie (XRF), die Partikel-induzierte Röntgenemission (microPIXE) und die nanoskalige sekundäre Ionenmassenspektroskopie (nanoSIMS). Sie haben jedoch nur begrenzte quantitative Aussagekraft, erfordern sehr aufwändige Präparationen oder hochspezialisierte Apparate, über die nur wenige Labore verfügen. Farb- oder Fluoreszenzmarkierungen sind oftmals nur begrenzt spezifisch oder ermöglichen es nicht, zahlreiche Elemente eines Gewebes gleichzeitig zu analysieren.
Fluoreszenz-aktivierte Zellsortierung und Plasmamassenspektrometrie
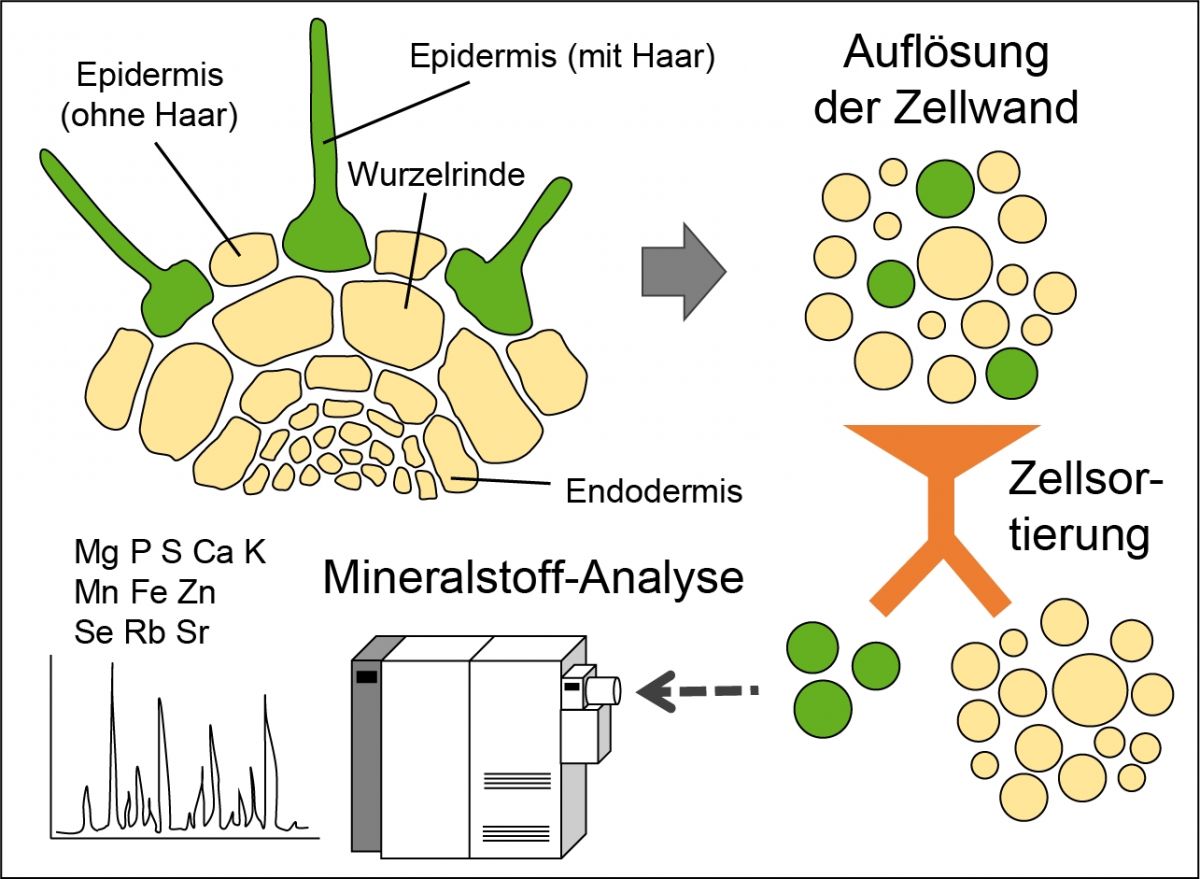
Die am Leibniz-Institut für Pflanzengenetik und Kulturpflanzenforschung (IPK) entwickelte neue Methode löst die Herausforderungen, in dem sie zwei Methoden miteinander kombiniert: Zum einen setzt sie auf die induktiv gekoppelte Plasmamassenspektrometrie (ICP-MS). Sie ist aktuell der beste Weg, um gleichzeitig die meisten Elemente des Periodensystems mit hoher Sensitivität genau zu quantifizieren. Allerdings ist die Methode für sich allein auf Proben ganzer Gewebe beschränkt, weil das Gewebe zunächst in einer sauren Lösung verdaut werden muss. Wie sich Mineralstoffe entlang verschiedener Wurzelzellschichten verteilen, kann deshalb auf diese Weise nicht kartiert werden. Zwar ist es möglich, Bereiche von Interesse zuvor mithilfe eines Lasers abzutrennen, um sie gezielt zu untersuchen - doch auch dann können die Elemente in Symplast und Apoplast nicht klar auseinandergehalten werden.
Anstelle eines Lasers haben sich die Forscher:innen daher dafür entschieden, die verschiedenen Zelltypen mittels Fluoreszenz-aktivierter Zellsortierung (FACS) zu separieren und danach die ICP-MS anzuwenden. Auf diese Weise sollte es möglich sein, die Verteilung und Zusammensetzung der Elemente einer bestimmten Zellpopulation auch mit deren spezifischen Transkriptom und Proteom in Korrelation zu setzen. Damit die FACS-Methode störungsfrei angewandt werden konnte, mussten die Forscher:innen bestehende Methoden der Protoplastenisolation und der Sortierung abwandeln. Die Präparationsdauer betrug maximal 90 Minuten, um Ionenverluste durch die dann einsetzende Zellwandverdauung zu verhindern.

Das Forschungsteam des IPK hat die Zellen der Arabidopsis-Wurzeln mit Fluoreszenz-aktivierter Zellsortierung (FACS) separiert und anschließend den Mineralstoffgehalt der Protoplasten mit induktiv gekoppelter Plasmamassenspektrometrie (ICP-MS) gemessen.
Bildquelle: © HeitiPaves / iStock.com
Konzentrationen von elf Mineralstoffen gleichzeitig bestimmt
An der Ackerschmalwand (Arabidopsis thaliana) hat das Team diesen neuen Ansatz erprobt. Dabei gelang es, gleichzeitig für bis zu elf unterschiedliche Mineralstoffe wie Kalzium, Magnesium, Zink, Eisen und Mangan die Konzentration in verschiedenen Zelltypen zu bestimmen. Für fast alle untersuchten Elemente nimmt die Konzentration demnach von den äußeren zu den inneren Zellschichten der Wurzeln zu.
Auch die Rolle einzelner Transporter ließ sich so untersuchen: Schalteten die Forscher:innen das Plasmamembranprotein Heavy Metal ATPase 4 aus, das daran beteiligt ist, Zink und Cadmium ins Xylem zu transportieren, erhöhten sich die endodermalen Zinkeinlagerungen. Noch deutlicher und unerwartet stiegen die Konzentrationen von Eisen und Kupfer. Störten die Forschenden das Protein Ferric Reductase Defective 3 - ein Citrattransporter, der im vaskulären Gewebe Ionen abtransportiert - akkumulierten sich dort neben Eisen auch Zink, Mangan und Calcium.
Vakuolen der Wurzelhaare verhindern bei Eisenmangel Manganvergiftung
Weiterhin beobachtete das Forschungsteam, wie sich bei Eisenmangel in den Wurzeln Mangan anreichert, das in solchen Situationen verstärkt von Pflanzen aufgenommen wird. Dazu vergrößert die Pflanze die Speicher in ihren Wurzelhaaren, um zu verhindern, dass erhöhte Mangankonzentrationen den Spross erreichen und dort toxisch wirken. Wenn eine Pflanze bei Nährstoffmangel zusätzliche Wurzelhaare ausbildet, könnte dies somit nicht nur dazu dienen, die Absorbtionsfläche zu vergrößern, sondern auch mehr Vakuolen zu schaffen, um Nicht-Eisen-Ionen abzufangen.
Wie die Gradienten von Zelle zu Zelle zustande kommen, wurde in dieser Studie nicht geklärt. Einfluss hat sicherlich, wie stark die jeweiligen Plasmamembran- und tonoplastischen Ionentransporter exprimiert werden. Aber auch die Häufigkeit der Plasmodesmata könnte beeinflussen, wie effizient der Transport zwischen benachbarten Zellschichten abläuft.
Mit der neuen Methode können allerdings nicht die Ionenkonzentrationen in einzelnen Zellen bestimmt werden, sondern nur von einer Population ausgewählter Protoplasten. Recht genau ist hingegen der relative Vergleich des Ionoms spezifischer Zelltypen und wie es sich durch genetische Faktoren oder äußere Einflüsse verändert.
Quelle:
Giehl, R., et al. (2023): Cell type-specific mapping of ion distribution in Arabidopsis thaliana roots. In: Nature Communications 14, 3351 (2023). DOI: 10.1038/s41467-023-38880-0.
Zum Weiterlesen auf Pflanzenforschung.de:
- Wurzel-Mikrobiom sorgt für Mineralstoffbalance - Wurzeldiffusionsbarrieren werden von Bakterien beeinflusst
- Längere Wurzeln, mehr Stickstoff - Steuerung des Seitenwurzelwachstums entdeckt
- Oszillierende Kalziumsignale - Wie Pflanzen Mangan im Boden messen
Titelbild: Anhand der Modellpflanze Ackerschmalwand erprobten die Forscher:innen ihre neue Methode zur Erforschung des Mineralstoffwechsels.(Bildquelle: © Carl Davies / CSIRO / CC BY 3.0)